DMD杜氏肌营养不良症最 新治疗药物研究小鼠模型实验测试
杜氏肌营养不良症(Duchenne muscular dystrophy,DMD)属于X连锁隐性遗传病,是一种严重的遗传性神经肌肉疾病,患者通常会出现进行性肌无力[1]和神经系统退行性病变等症状[2],是全球最常见的肌营养不良疾病。DMD多发于男性,是由X染色体上DMD基因突变引起的。该突变导致机体内缺乏功能性的dystrophin蛋白,dystrophin是连接细胞骨架和细胞外基质的关键蛋白,主要位于骨骼肌和心肌的细胞浆面,也表达在脑组织中。在DMD患者体内,dystrophin的功能缺失破坏了细胞膜结构的稳定性,增加了细胞内外通透性,导致细胞外的蛋白和钙离子内流、细胞内肌酸激酶等外流,进而导致炎症、凋亡等通路激活,最终造成肌纤维变性坏死、纤维组织增生等病变[3]。
在全球范围内,DMD的发病率约为1/3500-1/5000(新生儿),患者通常在3-5岁开始发病,20岁-30岁常因呼吸衰竭而死。在我国,每年大约有400-500例DMD患儿出生,总计DMD患者高达7-8万人。
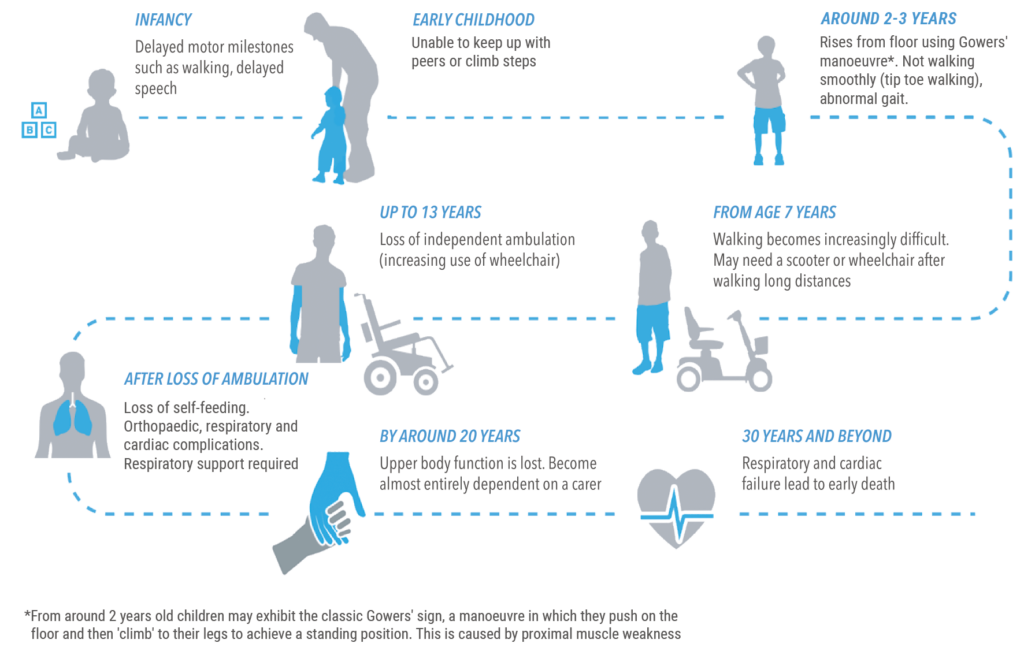
图1:杜氏肌营养不良发展进程(图片来源:What is Duchenne muscular dystrophy? | Duchenne & You (duchenneandyou.eu)
DMD杜氏肌营养不良症药物研发现状
目前尚无根治DMD的药物,现有的几种治疗策略仅能起到延缓病情的作用,主要包括皮质类固醇及反义寡核苷酸(ASO)疗法。用于治疗DMD患者的两种常见皮质类固醇药物是泼尼松和Emflaza,虽然可以起到减缓肌肉无力进展及延迟行动能力丧失的作用,但长期使用会带来骨骼变脆弱以及体重增加等副作用[4]。
1、外显子跳跃疗法:使约30%基因突变的DMD患者恢复部分功能
近年来,已有几款治疗DMD的ASO药物获批上市,如Sarepta和Dyne Therapeutics公司推出的Vyondys 53和DYNE-251,该治疗方式采用了较为新颖的“外显子跳跃”技术,自51 号外显子跳跃疗法药物Eteplirsen 2016上市以来,外显子跳跃治疗已成为DMD治疗的热点研究方向,越来越多外显子跳跃治疗药物将进入临床试验阶段。外显子跳跃疗法主要通过诱导删除特定的外显子,能使移码突变的mRNA阅读框恢复,可编码产生截短的Dystrophin蛋白,恢复其部分功能[5]。目前该疗法可使约30%基因突变的DMD患者(以外显子51、53和45为主)恢复部分功能。 该疗法的局限性在于这些药物只能覆盖少数特定突变位点的DMD患者,无法实现全面治疗作用。
2、基因疗法被寄予厚望
因皮质类固醇和ASO疗法需要长期给药,无法彻底治愈DMD,因此,能从根本上替代或纠正基因缺陷的基因疗法就成了无数患者、家庭和医生关注的目标。如PF-06939926疗法使用一种无害的腺相关病毒(AAV9)来传递一个微型肌营养不良蛋白基因,该基因将一种更小但具有功能性的肌营养不良蛋白编码到肌肉细胞中,使肌肉生成具有部分抗肌萎缩蛋白功能的重组蛋白,从而改善肌肉收缩能力。该疗法优势在于,它可以对携带任何类型DMD基因变异的患者生效,且可以让患者接受一次治疗之后,获得长期持久的改善。
集萃药康DMD小鼠在杜氏肌营养不良症DMD临床研究
DMD新药研发离不开合适的动物模型的加持。针对DMD的发病机制及常规治疗靶点,集萃药康利用基因编辑技术自主研发多种DMD模型,可用于DMD药物的筛选和相关机制的研究。
杜氏肌营养不良症DMD研究用小鼠品系

在DMD症治疗药物研究中小鼠模型实验结果
1、B10-Dmd-KO行为学验证数据—18-20周龄小鼠出现运动障碍

图2:B10-Dmd-KO小鼠16-20周龄抓力测试
实验结果显示:在抓力实验测试中,与B10对照组小鼠相比,18-20周龄B10-Dmd-KO小鼠四肢抓力显著降低,运动能力下降(***p<0.001,T检验)。

图3:B10-Dmd-KO小鼠18周龄转棒测试
实验结果显示:在转棒实验测试中,与B10对照组小鼠相比,18周龄B10-Dmd-KO小鼠在棒时间显著减少(***p<0.001,T检验)。
2、B10-Dmd-KO病理学验证数据—9-10周龄开始出现肌肉纤维退化、坏死,纤维组织增生
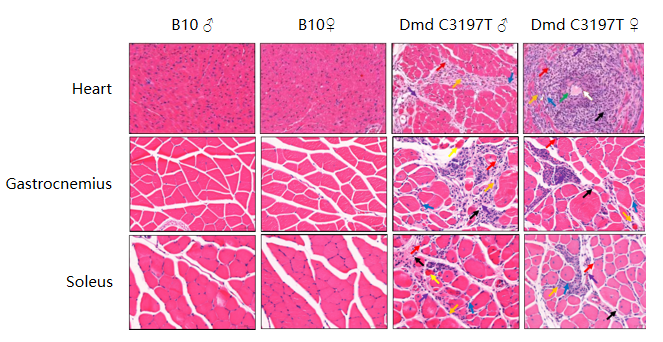
图4:B10-Dmd-KO小鼠9-10、22周龄肌肉病理检测
注:中性粒细胞(黑色箭头),肌纤维坏死(红色箭头),血管壁坏死(绿色箭头),纤维组织退化(蓝色箭头),Bar=50 μm。
实验结果显示:在肌肉病理检测中,与B10对照组小鼠相比,9-10周龄出现中性粒细胞增多,肌肉纤维退化、坏死,血管壁坏死和炎症细胞浸润等明显病理改变。
3、Dmd C3197T行为学验证数据—24周龄小鼠出现肌肉力量下降

图5:Dmd C3197T小鼠8-32周龄抓力测试
实验结果显示:在抓力实验测试中,与B10雌雄对照组小鼠相比,8-32周龄Dmd C3197T雌雄鼠四肢抓力显著降低,运动能力下降(n=12只/组,均值±SEM,*p<0.05,***p<0.001,T检验)。
4、Dmd C3197T病理学验证数据—32周龄小鼠出现显著肌肉纤维退化、坏死,中性粒细胞增多

图6:Dmd C3197T小鼠32周龄肌肉病理检测
注:肌纤维坏死(红色箭头),血管壁坏死(绿色箭头),纤维细胞(蓝色箭头),中性粒细胞(黑色箭头),淋巴细胞浸润(紫色箭头),成纤维细胞(橙色箭头);内皮细胞突入管腔(白色箭头),肌纤维萎缩(黄色箭头),Bar=20 μm。
实验结果显示:在肌肉病理检测中,与B10雌雄对照组小鼠相比,32周龄的Dmd C3197T雌雄鼠出现中性粒细胞增多,肌肉纤维退化、坏死,纤维组织增生和萎缩等明显病理改变。
5、Dmd-KO行为学验证数据—8月龄小鼠运动障碍明显

图7:Dmd-KO小鼠8月龄跑步机测试
实验结果显示:在跑步机实验测试中,与B6对照组小鼠相比,8月龄Dmd-KO小鼠运动距离与时间显著降低(n=12只/组,均值±SEM,**p<0.01,T检验)。
6、Dmd-KO病理学验证数据—8月龄小鼠的肌肉纤维退化、坏死、纤维组织增生和炎症细胞浸润

图8:Dmd-KO小鼠8月龄肌肉病理检测
注:肌纤维变性坏死(绿色箭头),淋巴细胞(蓝色箭头),Bar=50 μm。
实验结果显示:在肌肉病理检测中,与B6对照组小鼠相比,8月龄的Dmd-KO小鼠有肌肉纤维退化、坏死、纤维组织增生和炎症细胞浸润等明显病理改变。
参考文献:
[1] Bresolin N, Castelli E, Comi GP, Felisari G, Bardoni A, Perani D, et al. Cognitive impairment in Duchenne muscular dystrophy. Neuromuscul Disord. 1994;4:359–69.
[2] Kristin Wilson1, Crystal Faelan1, Janet C. Patterson-Kane1, et al. Duchenne and Becker Muscular Dystrophies: A Review of Animal Models, Clinical End Points, and Biomarker Quantification. Toxicol Pathol.2017 Jan 1:192623317734823.
[3] DMD:老病新知,孕育希望|医者仁心|罕见病|治疗|激素治疗|治愈_网易订阅 (163.com)
[4] DMD新疗法:5大候选药物概览 | 药时代 (drugtimes.cn)
[5] What is Duchenne muscular dystrophy? | Duchenne & You (duchenneandyou.eu)

