难以模拟人类复杂疾病和基因调控?集萃药康野化鼠来帮忙
实验室近交系小鼠有何局限性?为什么野化鼠更适合模拟人类复杂疾病和基因调控?集萃药康为您解读。
目前实验室广泛使用的实验小鼠,大多是20世纪初通过小家鼠近交得到的近交系小鼠品系[1],这些小鼠具有基因背景清晰、品系内个体一致性好、表型可重复性高等特点[2],但遗传多样性缺乏,加上长期人为饲养和选择的因素,许多疾病致病基因被选择淘汰,因此并不适合于人类复杂遗传疾病的研究。为解决遗传多样性的问题,一些科学家开始重新使用野外捕获的小家鼠来开展基因功能研究。野生小家鼠自然群体中存在丰富的遗传多样性,包括单核苷酸多态性(SNP)、序列的缺失(Deletion)和重复(Duplication),多样性远远超出了实验小鼠,是非常好的实验材料[3]。
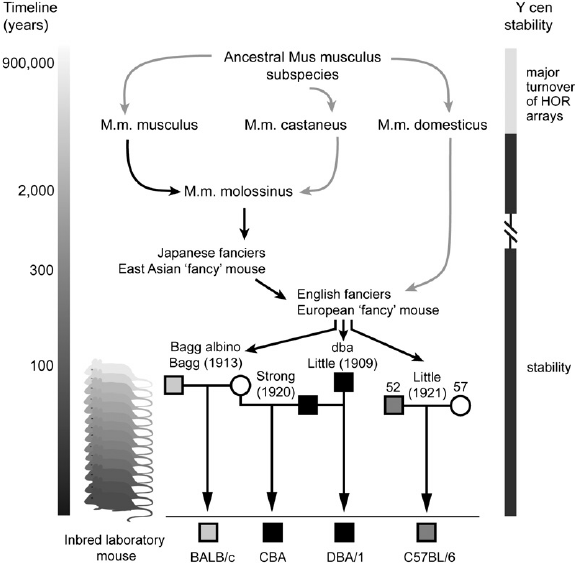
近交系小鼠的来源
但野生小家鼠由于来源的不稳定性、微生物风险和繁育困难等问题,在具体开展研究工作时,材料往往不能保障。同时,由于其基因背景的未知性以及繁育后基因的不稳定性,在研究某个特定性状或领域时,遗传背景过于复杂,也极大地增加了研究分析的难度。于是,以某种小鼠为遗传材料供体,通过不断回交至另一个近交系小鼠,培育出仅有一条染色体与其受体近交系不同的新近交系,叫作染色体替换系(Chromosome substitution strains,CSSs),成为更理想的模型。美国、日本及捷克等国科学家构建了小鼠全基因组染色体替换品系,A/J、CAST/Ei、MSM/Ms、PWD/Ph等全基因组染色体被逐一引进受体品系C57BL/6J小鼠基因组中[4]。在集萃药康的“野化鼠项目”中,研究团队通过染色体替换系的构建,将中国各地区的野外小鼠特定染色体引入遗传背景十分明确的实验小鼠中去,将丰富多样的野外小鼠的基因信息引入实验,为复杂性状相关基因定位克隆研究带来了十分明显的优势,也为复杂性状的研究提供了新资源和新思路。
野外来源染色体替换系具有更为广泛的连锁不平衡和更多的等位基因,在一条染色体范围内能精确定位QTL和快速鉴定基因,使得该类小鼠成为发掘QTL更为理想的模式生物。
此外,染色体替换系是迅速定位疾病相关染色体调控区段的有效工具,针对每一个染色体替换品系都可以进行广泛的性状研究。结合当下各种生信检测手段,可以很好地用于基因和SNP功能研究。例如在2022年,集萃药康与南京大学林兆宇课题组合作的一项研究通过对多个野外来源1号染色体替换系进行表型分析、全基因组测序分析和基因表达谱分析,发现多个免疫相关基因,包括Rufy4、Ifi203、Il1r1、Ifi205、Casp8、Cfhr1、Il1r2、Rgs1等可能参与到高脂血症的调节过程[5]。
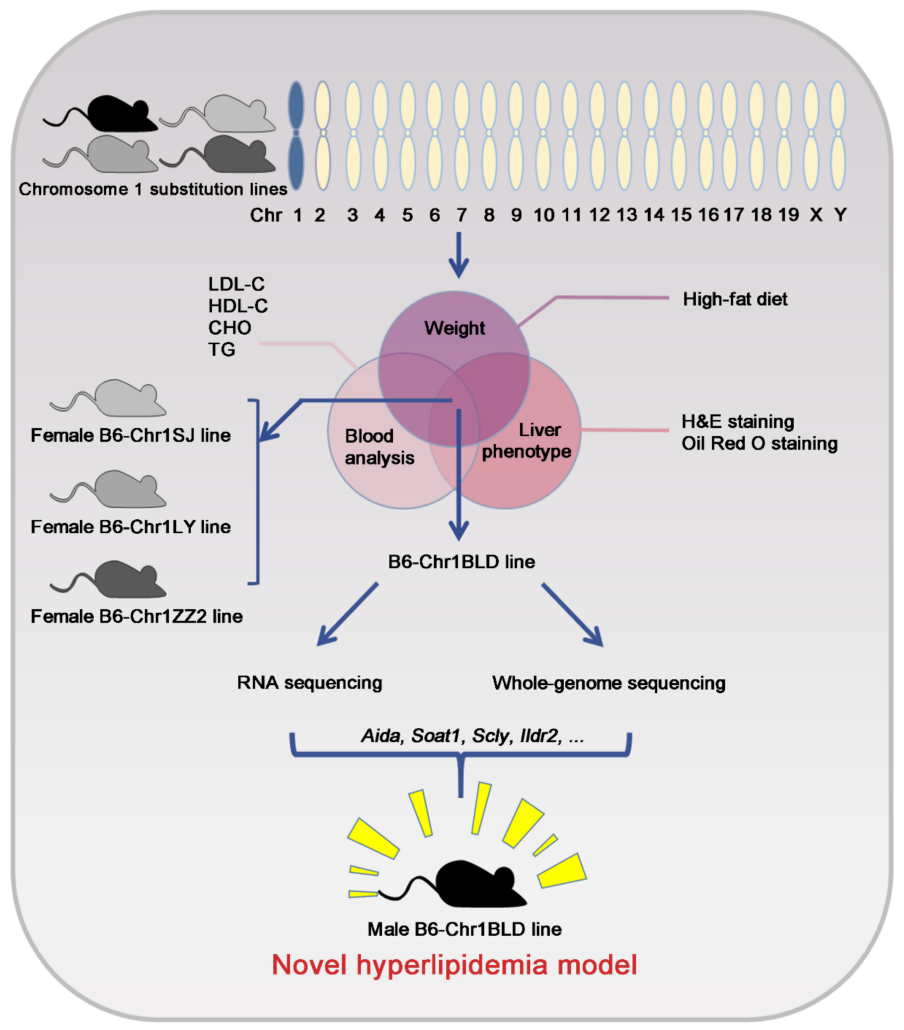
染色体替换系(CSSs)野外小鼠应用:
利用野外小鼠染色体替代实验小鼠染色体研究代谢、神经、免疫、生殖等方面的复杂疾病和性状调控机制,既提供了丰富的遗传多样性,又提供了统一的基因组背景和环境背景,不仅利于多基因调控的研究,还可用于基因与基因相互作用、基因与环境相互作用的研究。此外,野化鼠相比较于普通近交系B6小鼠,其肠道菌群具有显著差异,还可用于研究菌群多样性。欢迎咨询深入了解。
参考文献:
[1] Silver LM. Mouse genetics :concepts and applications. New York; Oxford: Oxford University Press,1995.
[2] Ferris SD, Sage RD, Wilson AC. Evidence from mtDNA sequences that common laboratory strains of inbred mice are descended from a single female. Nature, 1982,295(5845):163-165.
[3] Guenet JL, Bonhomme F. Wild mice: an ever-increasing contribution to a popular mammalian model. Trends Genet, 2003,19(1): 24-31.
[4] Gregorova S, Divina P, Storchova R, Trachtulec Z, Fotopulosova V, Svenson KL, DonahueLR, Paigen B, Forejt J. Mouse consomic strains: exploiting genetic divergence between Mus m.musculus and Mus m.domesticus subspecies. Genome Res, 2008. 18(3): 509-515
[5] Xu L, Minli S, Hao Q, Cunxiang J, Zhong C, Xiang G, Zhaoyu L. Identification of a chromosome 1 substitution line B6-Chr1BLD as a novel hyperlipidemia model via phenotyping screening. Metabolites, 2022,12(12),1276.

