神经系统疾病小鼠模型介绍:阿尔茨海默症小鼠模型上新啦
神经系统疾病是指发生于中枢神经系统或周围神经系统,以感觉、运动、意识、自主神经功能障碍为主要表现的一大类疾病,包括阿尔茨海默病、偏头痛、抑郁等多种类型。2024年3月,发表在《柳叶刀-神经病学》上的一项重大研究显示,截止到2021年,全球有超过30亿人患有神经系统疾病,约占全球总人口的43%,这个数字也让神经系统疾病超越了心血管疾病跃增为全球最*大疾病负担[1]。与肿瘤、自身免疫性疾病等相比,神经系统领域内的疾病机制大多不够清晰,药物研发壁垒更高,但是一旦有所突破,可以享有更长的生命周期;且由于多年未有新靶点的突破,能解决临床未满足需求的改良型新药仍旧具有很强的投资价值。

为了助力神经系统疾病的机制研究和药物研发,集萃药康布局相关领域,已自主设计研发三十余种神经系统疾病小鼠模型,可以很好地模拟各类型疾病的临床疾病表征,并且均拥有自主知识产权,为神经系统疾病的药物开发和机制研究提供更多解决方案。
以阿尔茨海默病(Alzheimer’s disease,AD)为例,AD是世界第*一大神经退行性疾病,同时也是一种以进行性认知功能障碍和行为损害为特征的中枢神经系统退行性疾病。用于诊断阿尔茨海默病的核心生物标记物包含了淀粉样蛋白PET、脑脊液Aβ42/40、脑脊液p tau181/Aβ42、脑脊液t-tau/Aβ42等。值得强调的是,与其他形式的磷酸化tau蛋白相比,血浆p-tau217与脑脊液具有最高的一致性,唯一在诊断和分期中都出现的血液生物标志物仅为p-tau217,血浆p-tau217预测临床准确性与PET高度一致,p-tau217在验证实验中还具有较高的稳定性和抗内源性干扰的能力,也促使其成为AD临床诊断的不二之选。
现有AD药物的研发主要围绕不同的致病机制假说来进行,包括Aβ淀粉样蛋白级联假说、磷酸化Tau蛋白致病假说、氧化应激假说以及神经炎症假说等等。集萃药康针对不同的致病假说,开发了多种阿尔茨海默症小鼠模型。其中不仅有国内首个拥有自主产权的FAD4T小鼠模型,同时上新提供聚焦于轻中度Aβ斑块聚集病理表征的FAD2T小鼠模型,以及有效模拟临床患者从诊断学到过度磷酸化的tau蛋白和Aβ斑块聚集病理表征至行为变化的FAD3T小鼠模型,可模拟AD患者疾病表征,用于AD治疗药物的筛选、安全性评价及发病机制研究。
『FAD2T模型数据展示』

图1. FAD2T小鼠模型4月龄起检测到Aβ斑块的聚集
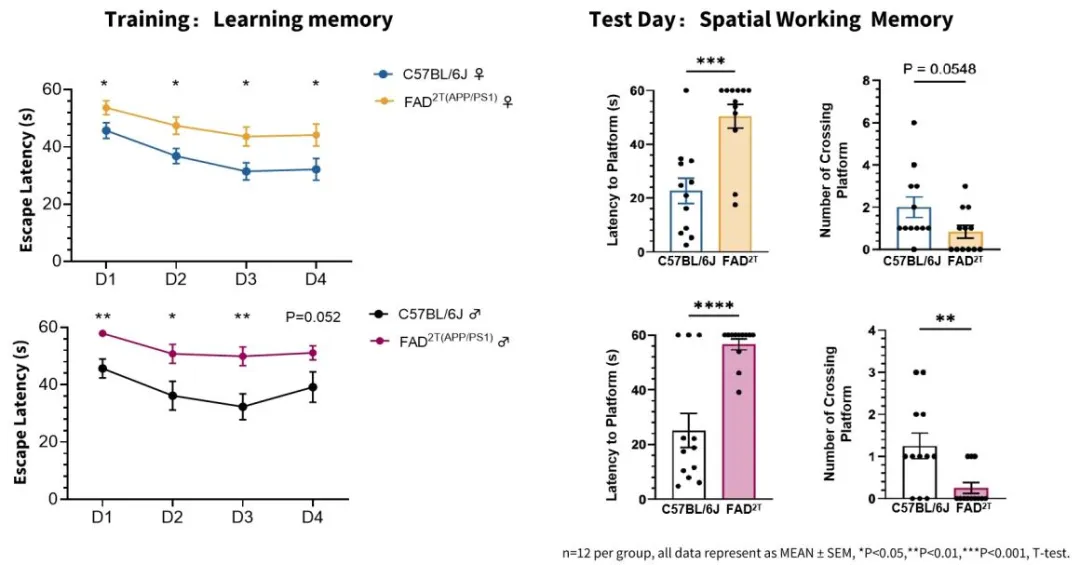
图2. FAD2T小鼠模型8月龄起出现学习认知障碍
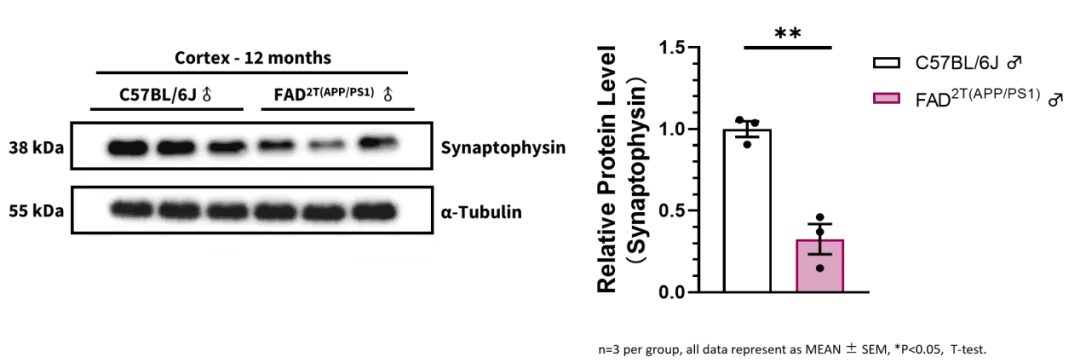
图3. FAD2T小鼠模型12月龄出现突触结构的丢失
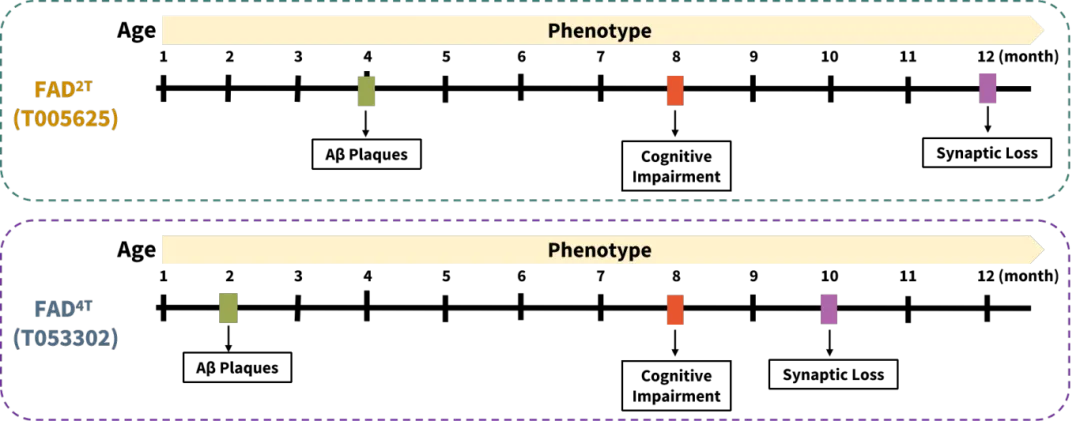
图4. FAD2T小鼠模型与FAD4T小鼠模型对比
与FAD4T小鼠模型相比, FAD2T小鼠模型表现出更晚的Aβ淀粉样蛋白聚集(~4月龄),更少的Aβ蛋白表达量,属于轻中度Aβ斑块聚集病理表征,且相对于FAD4T小鼠模型具有更长的药效窗口期,可以较好的用于疫苗或预防性治疗药物研发。但美中不足的是,FAD2T与FAD4T小鼠由于脑内缺少磷酸化Tau蛋白的表达,均无法完全模拟临床AD患者的主要病理特征。
因此集萃药康构建了全新的FAD3T小鼠模型,同时引入了人源携带突变的APP、PSEN1及MAPT基因。模型数据结果显示,FAD3T小鼠模型不仅符合AD患者临床诊断标准,能够在血液中检测到Aβ及p-Tau相关蛋白的表达(图5),2月龄起出现Aβ并逐渐聚集形成斑块(图6),且在小鼠脑内成功表达多种磷酸化位点Tau蛋白(图7,以AT8为例),满足临床AD患者的主要病理特征包括β-淀粉样蛋白形成的淀粉样斑块和过度磷酸化Tau蛋白形成的神经纤维缠结(NFT),符合临床AD患者的疾病发病进程(图8),是AD治疗药物筛选的不二选择。针对该模型,临床已获批AD药物的药效测试也在加速进行中,更多数据预计将在11月和大家见面,敬请期待~
『FAD3T模型部分数据展示』
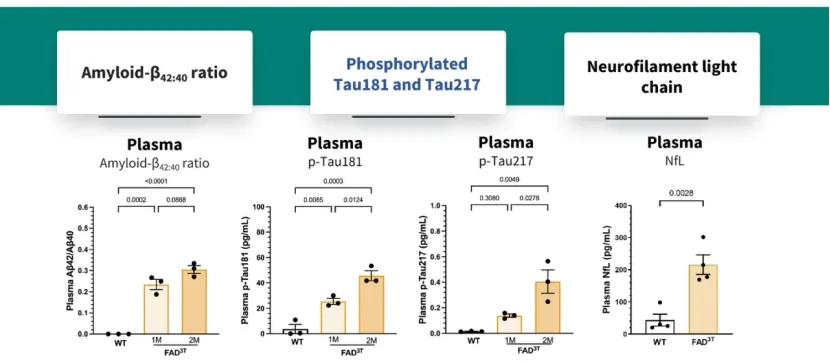
图5. FAD3T小鼠1月龄起血浆中可检测到Aβ、p-Tau及NfL的表达
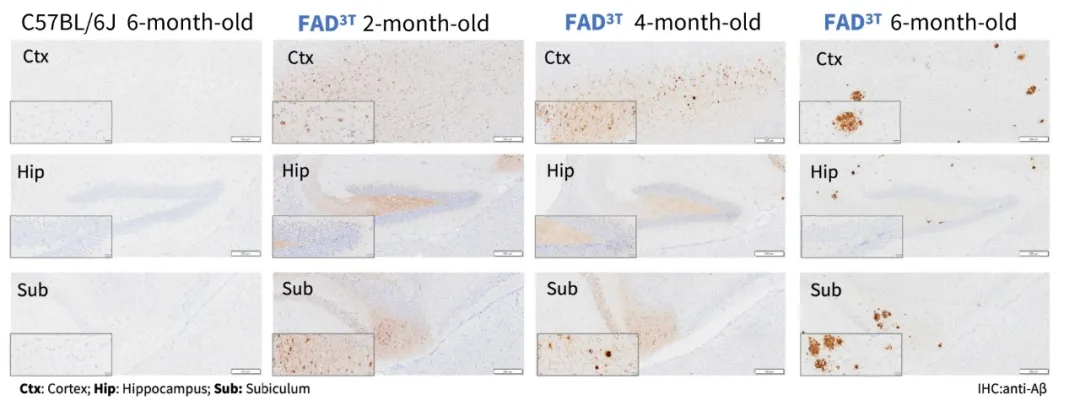
图6. FAD3T小鼠2月龄起检测到Aβ蛋白表达并逐渐聚集形成斑块

图7. FAD3T小鼠模型3月龄起检测到磷酸化Tau蛋白表达
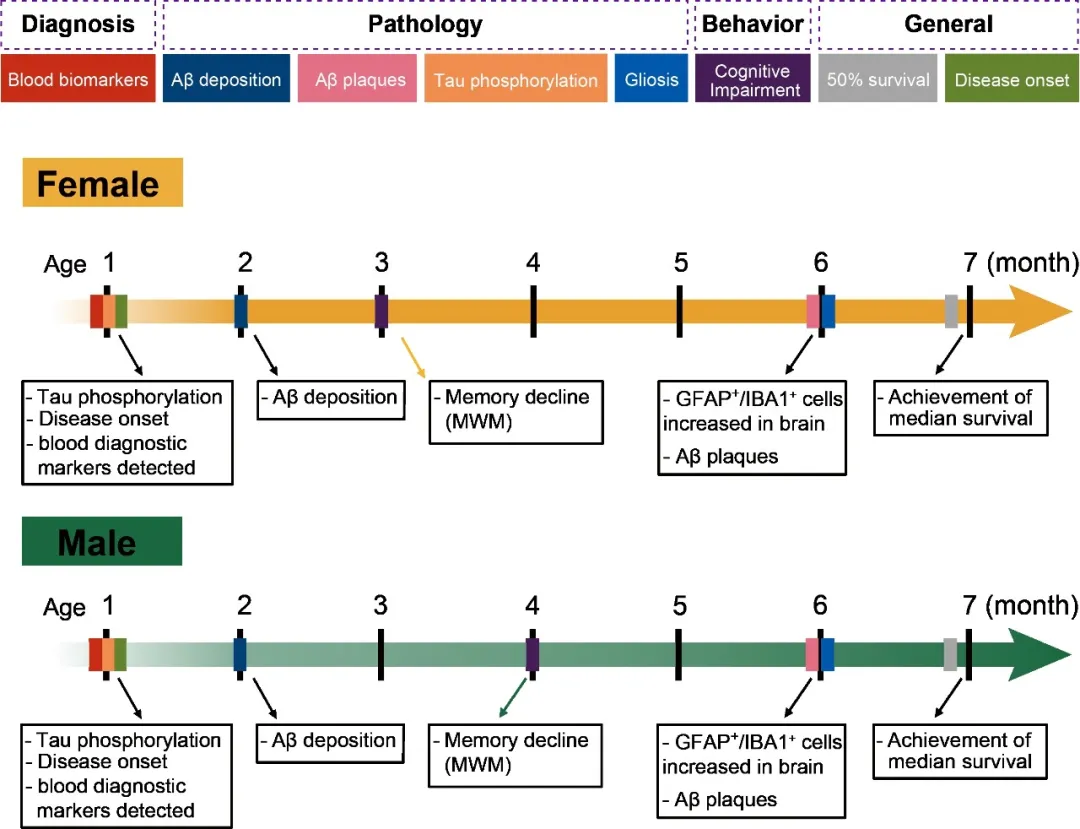
图8. FAD3T小鼠模型表型特征总结
参考文献
[1] Steinmetz, Jaimie D et al. Global, regional, and national burden of disorders affecting the nervous system, 1990–2021: a systematic analysis for the Global Burden of Disease Study 2021. The Lancet Neurology, Volume 23, Issue 4, 344 - 381

