降低抗体药物免疫原性的研发策略有哪些?集萃药康抗体人源化小鼠有何优势?
当前,降低抗体药物免疫原性的研发策略有哪些?抗体人源化小鼠作为降低抗体药物免疫原性的重要工具,又具备哪些优势?集萃药康为您解读。
自1986年第*一个鼠源性抗体药物-Orthoclone(OKT3)获FDA批准后,抗体药物进入了快速发展阶段。截至2023年10月,FDA已批准了163款单抗药物。抗体药物已成为近年来新药开发的主要类别,可用于治疗癌症、自身免疫性疾病、炎症性疾病及微生物感染等多种疾病。
然而,作为一类基于蛋白质的药物,有些抗体药物具有较高的免疫原性,容易引发患者免疫应答而产生抗药物抗体(anti-drug antibody,简称ADA),减弱药物治疗效果,甚至形成复合物造成严重的副作用。ADA免疫反应形成机制复杂、影响因素多样、临床前预测困难,导致ADA已成为抗体药物研发中面临的一个重大挑战。
ADA对抗体药物有哪些影响?
ADA对抗体药物的临床影响,主要集中在抗体药物的疗效,药代和安全性。
1)影响药物浓度和疗效:ADA的存在可能导致药物血清浓度降低至亚治疗水平,影响药物的疗效。在类风湿性关节炎(RA)患者中,使用TNF抑制剂(如阿达木单抗和英夫利昔单抗)治疗时,ADA阳性患者的药物谷浓度显著低于ADA阴性患者,且无ADA的患者通常显示出比有ADA的患者更好的临床结果。
2)加速药物清除:ADA可以改变生物制剂的药代动力学(PK)特性,通过引起ADA-药物复合物的加速清除,导致更低的暴露量(AUC)以及更低的最*大浓度(C-max)和更短的消除半衰期(t-1/2),这对治疗效果有重要影响。
3)毒性反应:ADA最常见的毒性效应是输液相关反应(IRRs),包括过敏反应和细胞因子释放综合征。这些反应可能由IgE介导,也可能由IgG或IgM的ADA介导,导致炎症反应和临床症状,如发热、皮疹、低血压等。
目前已有多款抗体药物因ADA影响其有效性和安全性,最终导致药物终止临床或退市。如辉瑞的PCSK9抗体Bococizumab Ⅲ期临床试验中,48%的患者在用药1年后检测到了ADA,且接受治疗的患者中有29%的患者检测到的是中和抗体(NDA),导致药物浓度骤降、疗效丧失(Harris & Cohen, 2024),最终该产品在2016年11月宣布终止开发,损失超10亿美元;无独有偶,艾伯维开发的IL-2R抗体Daclizumab于2016年被批准用于治疗多发性硬化症,因ADA引起严重肝毒性和脑炎,部分患者出现不可逆器官损伤,没有很好的解决方案,最终于2018年退市。
抗体药物ADA产生的原因?
抗体药物的免疫原性形成原因复杂,主要可以从患者相关因素和药物相关因素两个方面来考虑(图1及表1)。
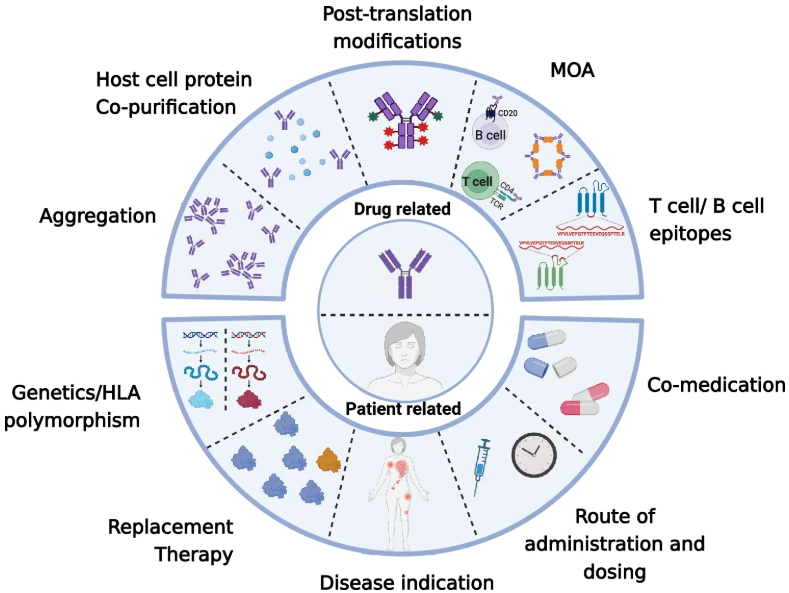
图1 抗体药物ADA的形成因素
表1:抗体药物ADA的形成因素及描述

在药物研发中,如何降低抗体药物ADA风险?
根据抗体药物ADA的形成因素,已有多种策略来限制免疫原性风险并在治疗前或治疗期间减轻ADA风险(图2),包括优先给予人源化或全人mAb进行治疗、修改给药方案、联合用药等降低ADA发生的风险等。
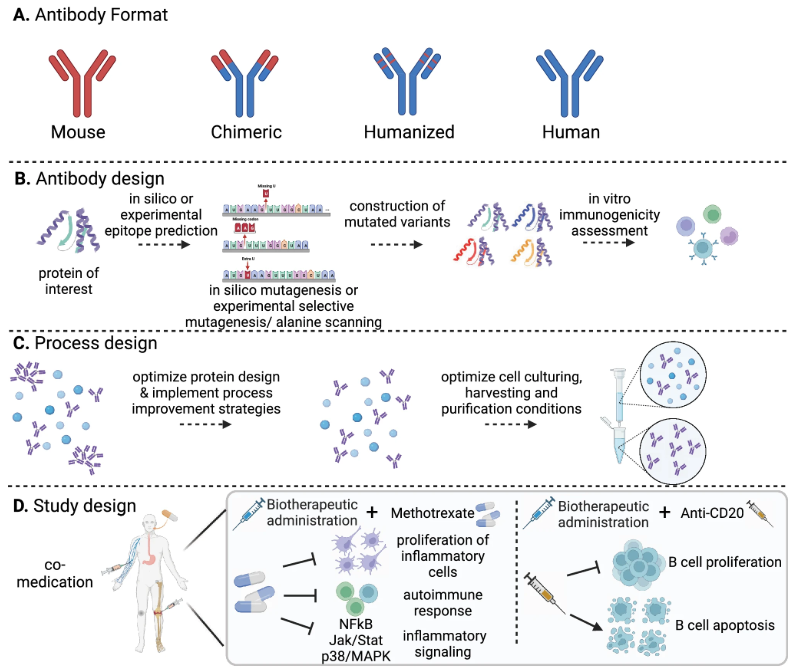
图2 降低抗体药物ADA的策略
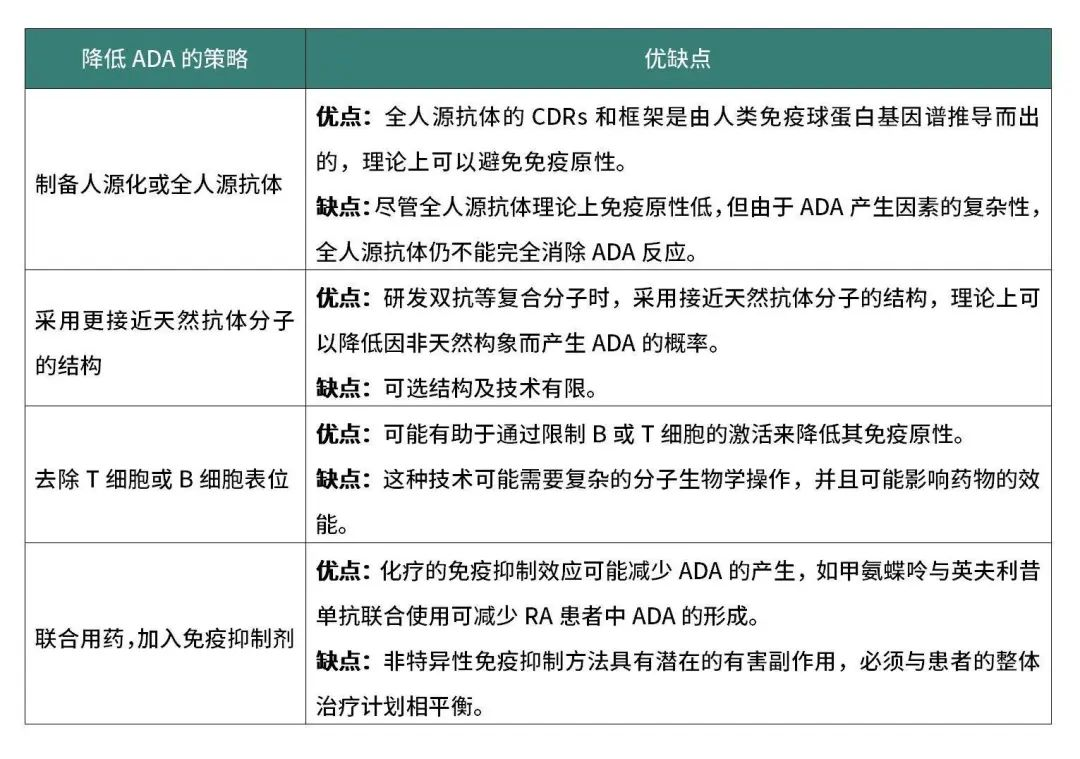
表2:降低抗体药物ADA的策略及优缺点
临床前ADA检测及评估方法的局限性
临床前ADA的检测方法,如酶联免疫法(ELISA)、放射免疫沉淀法(RIPA)、表面等离子体共振法(SPR)、电化学发光法(ECL)、全自动纳升级免疫分析工作站(Gyrolab)等。虽然这些方法能在一定程度上检测抗体药物的ADA,但是仍存在较多的局限性:
①这些免疫测定是非定量的,因为没有标准化的人多克隆ADA参考物质。
②临床ADA发生率受多种因素的影响,例如检测敏感性、样品处理和样品收集时间,这些因素阻碍了比较蛋白质治疗药物之间ADA率的能力。
③收集、分析和报告免疫原性结果的术语和方法缺乏标准化,这增加了协调临床ADA数据的复杂性。
④ADA在患者群体中的发病率差异很大,具体取决于疾病和具体的治疗方案,以及患者相关因素,如遗传、免疫状态和合并症[3]。
⑤临床前免疫原性研究的转化率较低,目前已有的临床前研究模型或方法不能准确预测抗体在临床应用中产生ADA的风险。
既然不能在临床前有效地检测或预测抗体药的ADA。那么,就需要在临床前降低抗体药物的ADA风险,规避抗体药物在治疗中产生ADA。如上文表2所述,在不同的降低ADA的策略中,最行之有效的方法就是制备人源化或全人源抗体。
人源化抗体和全人源抗体在临床实践中的免疫原性风险对比?
据研究统计,相较于人源化抗体,全人源抗体降低ADA效果更佳,其ADA率与抗体序列相关性主要体现在以下三个方面。
①抗体序列人源化程度:人源化抗体是在嵌合抗体的基础上将编码抗体的框架区及部分CDR替换为人源序列,人源化抗体的人源化程度通常在90%以上,但为了保持抗体亲和力及功能特性,部分CDR序列仍为鼠源序列。然而全人源抗体的人源化程度为100%。
②编码抗体的V/J基因错配率:如图3B所示,统计的临床上93个人源化或全人源抗体V/J基因的错配率与ADA率的关系,错配率越高产生的ADA则越高。如图3A所示,与人源化抗体相比,全人源抗体V/J错配率更低,相应的ADA率也更低(V/J为编码抗体的基因片段,V/J的匹配率代表与BCR族库中V/J基因的匹配度)。
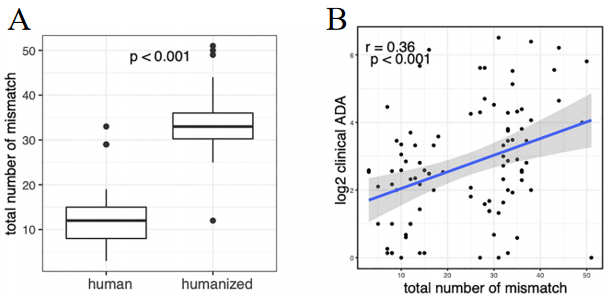
图3 人源化抗体和全人源抗体的V/J总错配率与ADA发生率的关联性
③抗体重链和轻链的匹配度:如图4A,B所示,统计了临床人源化抗体(43个)和全人源抗体(50个)的重链和轻链匹配率。与人源化抗体相比,全人源抗体的重链和轻链的V区基因匹配率更高,而ADA率更低(抗体重链和轻链的匹配率为对标BCR组库的天然抗体重链和轻链V区的匹配率)。
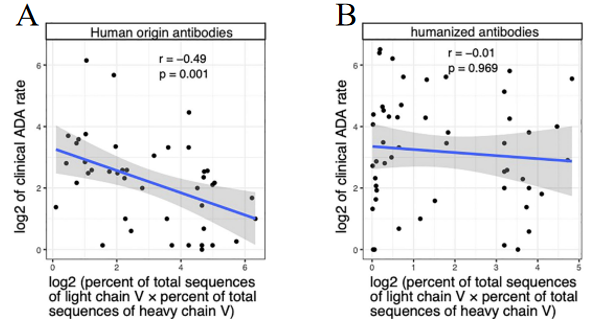
图4 临床单抗药物的ADA率与人源性抗体轻链和重链中V等位基因使用关联
通过对已获批抗体及在临床研究阶段的抗体进行统计分析,可以看到全人源抗体具有明显优势。特别是以NeoMab为代表的全人源抗体转基因动物为基础的抗体发现技术平台,全人源抗体可以在免疫健全的动物体内经历天然筛选和成熟,完整的人类重链及Kappa轻链基因库保障了NeoMab™小鼠拥有丰富的序列多样性,BALB/c遗传背景及功能完整的MHC共同造就了NeoMab卓越的免疫响应。
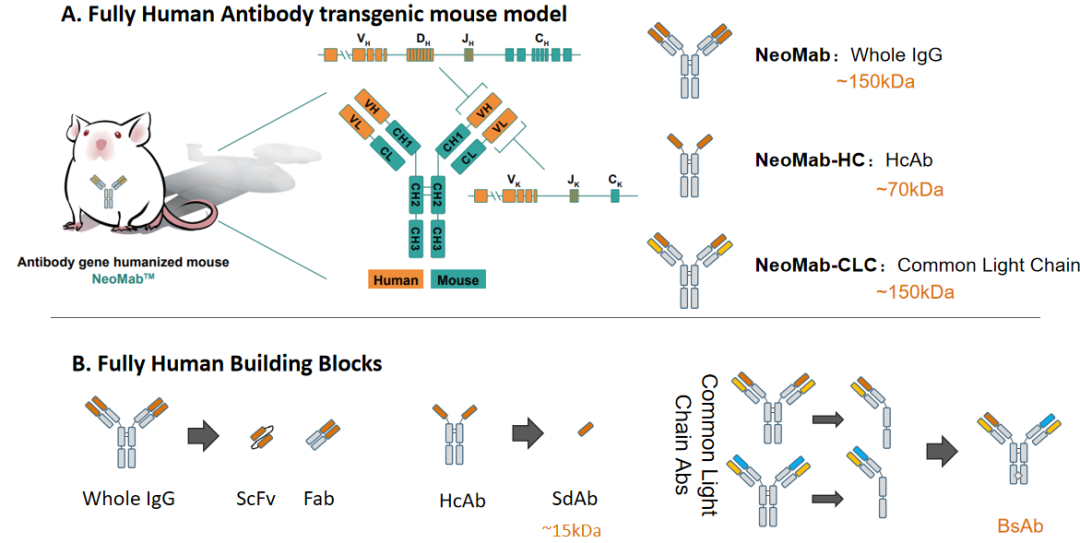
图5 NeoMabTM模型人源化策略
NeoMab的抗体人源化小鼠包含三种版本:NeoMab-IgG,NeoMab-HC及NeoMab-CLC分别产生标准IgG,单重链抗体及共轻链抗体。值得一提的是,NeoMab-CLC来源的全人源共轻链抗体适用于组成更接近于天然抗体构象的IgG like双抗,从结构上降低ADA产生的概率。在这些全人源转基因小鼠模型的支持下,通过免疫及筛选即能快速获得SvFv, Fab, SdAb及BsAb等各种全人源的模块,像乐高一样拼装成各种不同形式的全人源新药。欢迎联系我们获取更多细节:BD@neomab-bio.com
参考文献
[1].Lu R M , Hwang Y C , Liu I J ,et al.Development of therapeutic antibodies for the treatment of diseases[J].Journal of Biomedical Science, 2020, 27.DOI:10.1186/s12929-019-0592-z.
[2].Harris C T , Cohen S .Reducing Immunogenicity by Design: Approaches to Minimize Immunogenicity of Monoclonal Antibodies[J].BioDrugs: Clinical immunotherapeutics, biopharmaceuticals, and gene therapy, 2024, 38(2):205-226.DOI:10.1007/s40259-023-00641-2.
[3].Vaisman-Mentesh A , Gutierrez-Gonzalez M , Dekosky B J ,et al.The Molecular Mechanisms That Underlie the Immune Biology of Anti-drug Antibody Formation Following Treatment With Monoclonal Antibodies[J].Frontiers in immunology, 11:1951[2024-12-12].DOI:10.3389/fimmu.2020.01951.
[4]. Hu Z , Cohen S , Swanson S J .The immunogenicity of human-origin therapeutic antibodies are associated with V gene usage[J].Frontiers in Immunology, 2023.DOI:10.3389/fimmu.2023.1237754.

