Nature重大发现:孕期缺铁会影响胎儿性别?
在哺乳动物中,性染色体决定性别:XX为雌性,XY为雄性。而实际上,真正的性别分化则需要精确的基因表达程序。对于雄性胚胎,位于Y染色体上的Sry基因是启动睾丸发育的“总开关”。它只在胚胎发育的特定时间窗口(在小鼠中约 E10.5-E12.5 天),在性腺前支持细胞中短暂高表达,指挥性腺向睾丸方向发育。
一项最新的 Nature 研究显示,孕期小鼠缺铁,竟会导致小鼠胚胎从雄性转变为雌性!既往研究表明,铁在细胞内众多氧化还原反应中发挥着不可替代的作用,特别是对于JmjC家族组蛋白去甲基化酶而言,亚铁离子(Fe(2+))是其维持活性的核心辅因子。该研究首次揭示了母体铁缺乏如何通过影响胚胎性腺中的铁代谢和表观遗传调控,导致雄性胚胎发生性别逆转。

小鼠模型构建和实验设计
该研究中,科学家们构建了多种小鼠模型,以模拟母体铁缺乏对胚胎性别决定的影响。首先,他们利用Wt1creERT2小鼠模型,诱导性表达Cre重组酶,特异性地敲除性腺体细胞中的铁摄取基因Tfrc。这种条件性敲除(cKO)模型能够在胚胎发育的关键时期(如E8.5)精确地干预铁代谢。
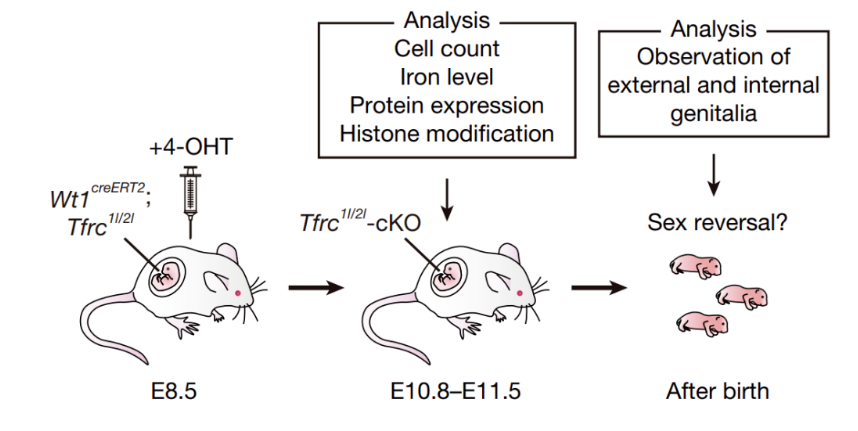
图1. 实验小鼠模型构建
此外,研究者们还引入了Hsp-Sry-tg小鼠模型,通过热休克蛋白启动子驱动 Sry 基因的表达,用于验证铁缺乏导致的 Sry 表达抑制是否是性别逆转的直接原因。
药物诱导缺铁:在怀孕小鼠在 E6.5 到 E10.5 期间,每天口服铁螯合剂去铁胺(DFX),模拟急性母体铁缺乏。这种处理方式能够在短时间内显著降低母体和胚胎的铁水平。
饮食诱导缺铁:让部分怀孕小鼠在孕前 4 周以及整个孕期食用低铁饮食,直至分娩。这种长期的铁缺乏处理方式能够模拟慢性母体铁缺乏对胚胎发育的影响。
因此,研究者们能够在不同的时间尺度和铁缺乏程度下,系统地研究母体铁缺乏对胚胎性别决定的影响。
铁缺乏会导致性腺Sry基因表达受阻
在体外培养的性腺实验中,当在培养基中加入铁螯合剂去铁胺(DFO)时,XY 性腺中的 Sry 表达显著降低,甚至几乎完全消失。进一步的分析显示,DFO 处理显著增加了 Sry 启动子上的 H3K9me2 水平,表明铁缺乏通过抑制 KDM3A 介导的 H3K9 去甲基化,导致 Sry 表达受阻。
在经过DFO处理的XY性腺里,睾丸标志物SOX9受到显著抑制,反而是卵巢标志物FOXL2(+)表达明显升高。而XX性腺在DFO处理后,未出现显著变化。后续实验表明,Sry基因恢复表达后,DFO处理过的XY性腺可以恢复男性型性腺的分化路径。这表明,铁缺乏导致的Sry基因表达缺失,正是造成性别逆转的关键因子。
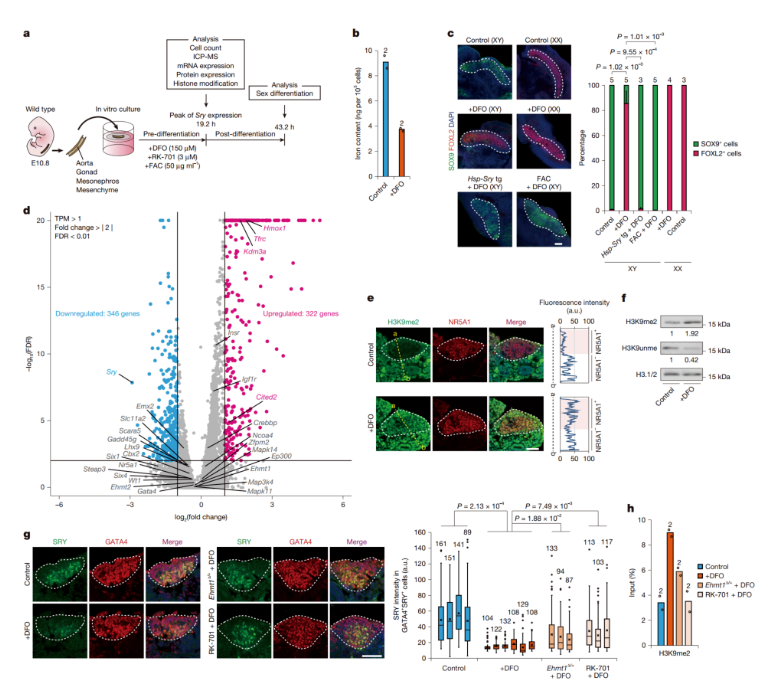
图3. 铁缺乏导致培养性腺中Sry激活受阻
母体铁缺乏胚胎性别发生逆转
在体内实验中,研究者通过药物诱导和饮食诱导两种方式,成功诱导了母体铁缺乏,并观察到了显著的性别逆转现象。在DFX处理的母鼠中,部分 XY 胚胎出现了雄性向雌性性别逆转,表现为出生后的小鼠具有两个卵巢或一个卵巢和一个睾丸。同样,在长期食用 IDD 的母鼠中,部分 XY 胚胎也表现出性别逆转,且这种现象在具有特定遗传背景(如 Kdm3aΔ/+ 杂合突变)的小鼠中更为明显。
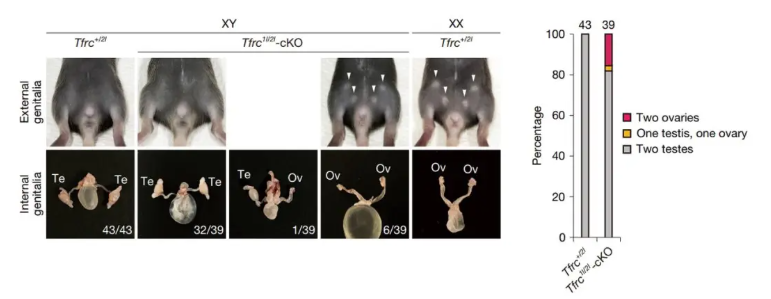
图4.Tfrc1/21 cKO小鼠发育情况
铁缺乏导致性别逆转的分子机制
从分子层面来看,与Sry基因表达相关的早期性腺发育基因表达并未受到影响,而Sry基因表达显著降低。进一步研究发现,DFO处理导致Sry启动子区域的H3K9me2水平近乎翻倍。这表明,铁缺乏时,KDM3A介导的H3K9去甲基化过程受阻,从而影响了Sry基因的正常表达。
为了证实铁代谢在性别决定中的关键作用,研究人员对Tfrc基因进行了条件性敲除。结果发现,与对照组相比,Tfrc(1l/2l )敲除后,胚胎性腺细胞内的Fe²⁺水平显著降低,H3K9me2水平翻倍,Sry mRNA表达量减少约一半,SRY蛋白表达降低了约 50%。
在胚胎发育阶段(E13.5),部分XY Tfrc(1l/2l )敲除胚胎的性腺出现发育异常,表现为卵巢和睾丸组织混合。成年后检查发现,在 39 只 XY Tfrc(1l/2l )敲除小鼠中,有 6 只完全出现雄性向雌性性别逆转,表现为双侧卵巢,另有 1 只部分雌性化,一侧为卵巢,另一侧为睾丸。
在胚胎性别决定阶段(E6.5 至 E10.5),当研究人员给怀孕母鼠口服铁螯合剂DFX后,约7%的XY后代发生了雄性到雌性的性别逆转——在72只XY小鼠中,4只发育出双侧卵巢,1只发育了一个卵巢和一个睾丸。
图5:药物诱导的母体铁缺乏导致胚胎性别逆转
在母体低铁饮食实验中,研究人员让母鼠在孕前 4 周及整个孕期食用低铁饮食。实验结果表明,单独的低铁饮食对性别决定并无显著影响。但当母鼠携带Kdm3a基因杂合突变时,低铁饮食导致约5%的XY后代发生性别逆转。在43只XY小鼠中,有2只发育出双侧卵巢。
单细胞 RNA 测序结果显示,在E11.5小鼠性腺中,与铁摄取和Fe²⁺产生的基因在前Sertoli 细胞中的表达更为丰富,而铁储存基因则相反。
免疫组织化学与荧光染色实验表明,在E11.5小鼠性腺中,铁摄取相关蛋白TFR1和Scara5以及Fe²⁺产生相关蛋白Ncoa4和HO1的表达水平较高。荧光探针检测显示,E11.5性腺中 Fe²⁺的荧光信号强度较高,表明性腺细胞中Fe²⁺积累较多。ICP-MS 分析结果也进一步证实了这一点——NR5A1(+)细胞中的总铁含量比NR5A1(−) 细胞高1.8倍。
图6.饮食引起的母体铁缺乏损害了子宫内发育中的胚胎性别判定途径
集萃药康相关服务介绍
KO/CKO小鼠是研究分子机制的有力工具,其模型选择直接影响科研项目的成败。集萃药康的斑点鼠计划(Knock-out All Project,KOAP)通过系统敲除热点基因,成功构建了覆盖肿瘤、代谢、免疫、发育以及DNA与蛋白修饰等多个研究领域的KO/CKO小鼠资源库。目前,该计划已建成全球规模最大的基因敲除小鼠资源库,拥有近3万个品系,为生命科学研究与药物研发提供核心支撑。
作者:市场中心 小麦
审核:小麦、艾薇
编辑:艾薇
参考文献
Nature Communications volume 16, Article number: 2185 (2025)


