裸鼠长毛≠免疫恢复!流式数据+荷瘤因素全解析
裸鼠作为免疫缺陷研究的“老将”,常常会打破大家的认知,长出一些毛发——但这真的意味着它们的免疫系统“恢复”了吗?今天,我们就来聊聊裸鼠长毛背后的科学逻辑,以及真正影响荷瘤实验的关键因素。
了解裸鼠
Foxn1基因(forkhead box N1,又称 Hfh11、Fkh19)是胸腺上皮细胞中的一种关键转录因子,参与免疫系统的调节和代谢,在癌症和衰老中发挥重要作用[1]。当小鼠的Foxn1基因发生纯合突变时,会引发两大标志性缺陷:
· 胸腺上皮发育缺陷:T细胞无法成熟,造成免疫缺陷;
· 毛发生长异常:角蛋白分泌紊乱,导致毛发无法正常穿透皮肤,表现为扭曲、断裂的毛发,看似"无毛"。因此让突变小鼠获得了"裸鼠"的称号。
裸鼠为什么长毛?
由于Foxn1基因功能缺失,毛杆中缺乏角蛋白,变得非常纤弱,绝大部分毛杆不能正常穿透表皮,而是扭曲盘绕在膨胀的毛囊漏斗内,因此裸鼠皮肤眼观上为光裸的。但从组织学切片来看,裸鼠毛囊与同窝出生的正常有毛鼠相比,毛囊数量和功能均没有差别,能够产生正常的毛根和毛杆[2]。
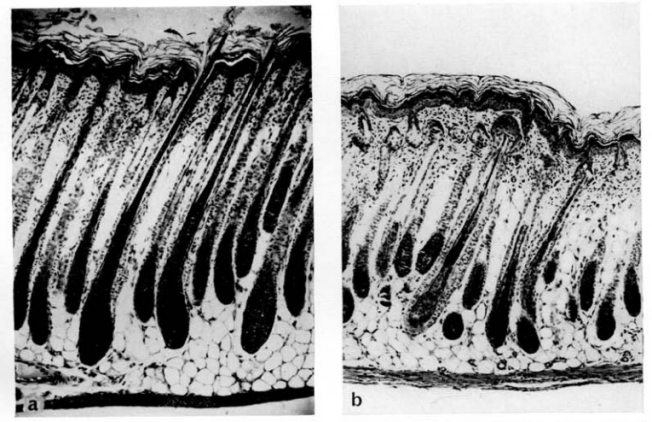
图1. 6日龄小鼠毛囊纵切面[2](a.正常鼠 b.裸鼠)
由于裸鼠皮肤眼观上为光裸的,很容易由此引起了人们的误解:“裸鼠”就是“体表无毛的”。但实际上裸鼠出生后约10天左右,在头部、颈部可见稀疏的毛发生长。随着周龄增加,在躯干的其他部位也可见稀疏毛发生长。这些穿透了表皮的毛杆也是严重扭曲的,而且经常在长到应有长度前就折断了。因此大家看到的是稀疏、较短的被毛。
根据我们的繁育经验:裸鼠在4w时会出现长毛(长毛高峰期),到6w之间会出现周期性的长毛及褪毛,7w时部分小鼠再次长毛,此时毛发不易脱落。
裸鼠长毛是免疫缺陷能力恢复吗?
上文提到,裸鼠因Foxn1基因突变导致毛发生长异常和胸腺发育缺陷两种主要表型,但这两种表型是独立的,移植胸腺不会改善毛发情况。Gordon J. Eaton团队研究比较了裸鼠(nu/nu)、接受胸腺移植的裸鼠(nu/nu)以及杂合子(nu/+)小鼠的毛发生长情况,发现接受胸腺移植的裸鼠免疫功能可恢复,但其毛发生长规律与未接受移植的裸鼠一致,说明胸腺缺失与否和毛发生长规律无直接关系[3]。
对此,我们专门开展了相关验证实验,对5周龄长毛裸鼠和5周龄无明显毛发裸鼠进行免疫细胞流式检测,分析长毛现象与免疫缺陷是否具有关联性,结果显示长毛裸鼠具有正常的免疫缺陷表型,与是否长毛关。


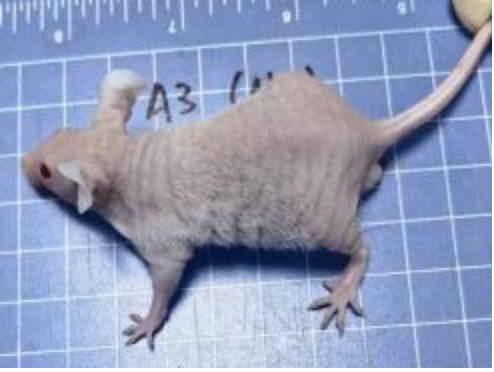


图2. 长毛BALB/c-Nude的外观(从上到下编号分别为A1-A5,雄鼠,5周龄)


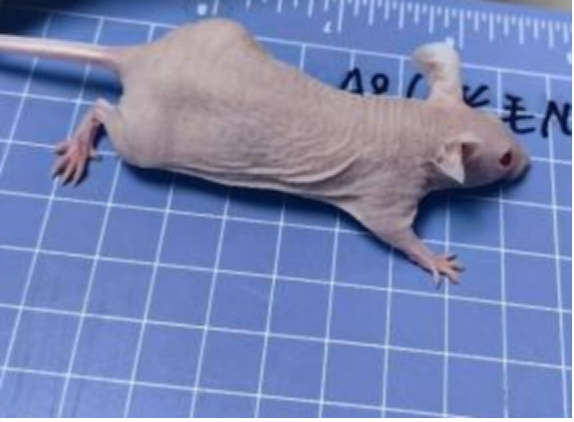

图3. 体表无明显毛发的BALB/c-Nude及BALB/cJGpt对照小鼠外观(从上到下分别为A6-A9,雄鼠,5周龄)
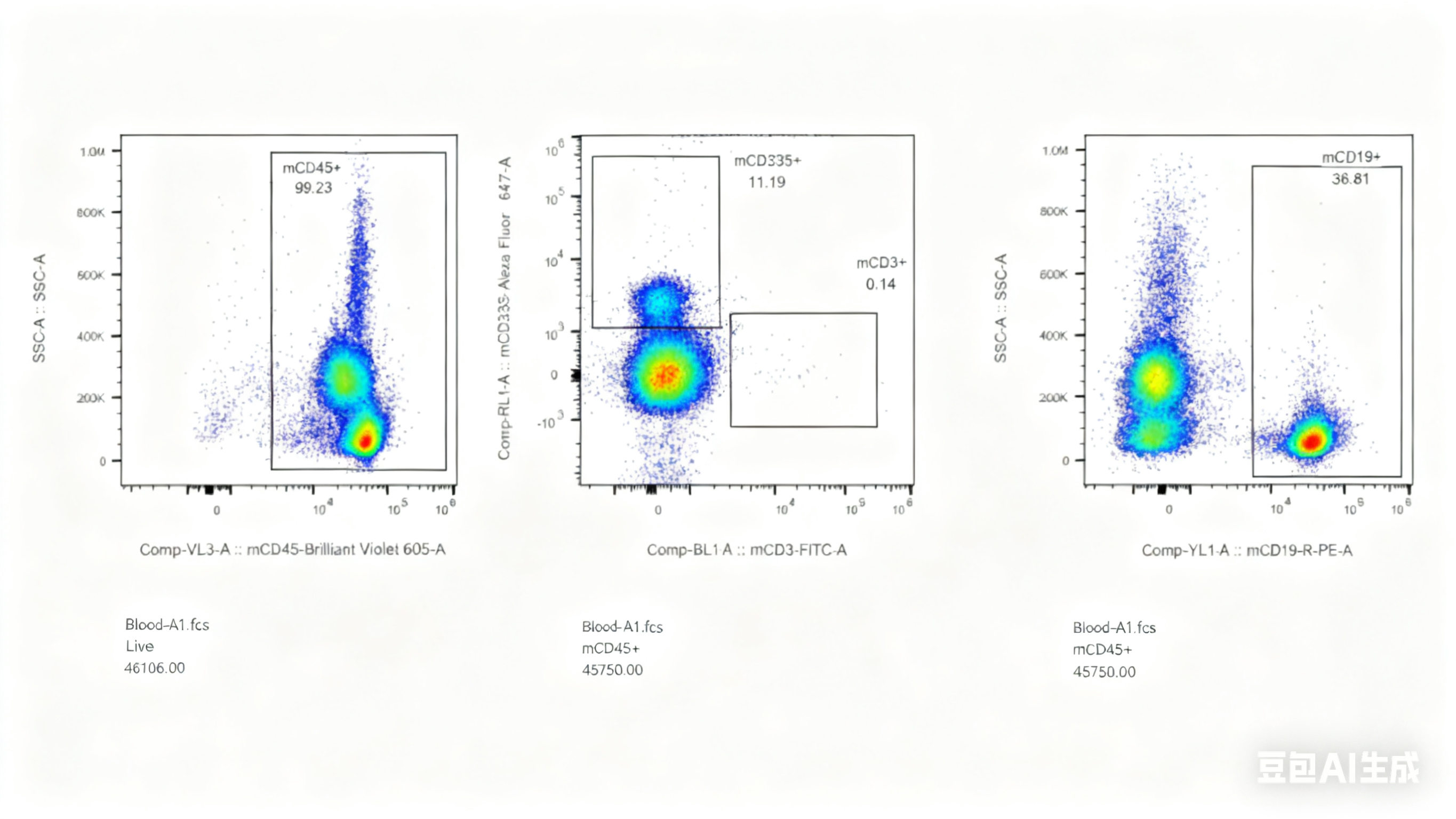
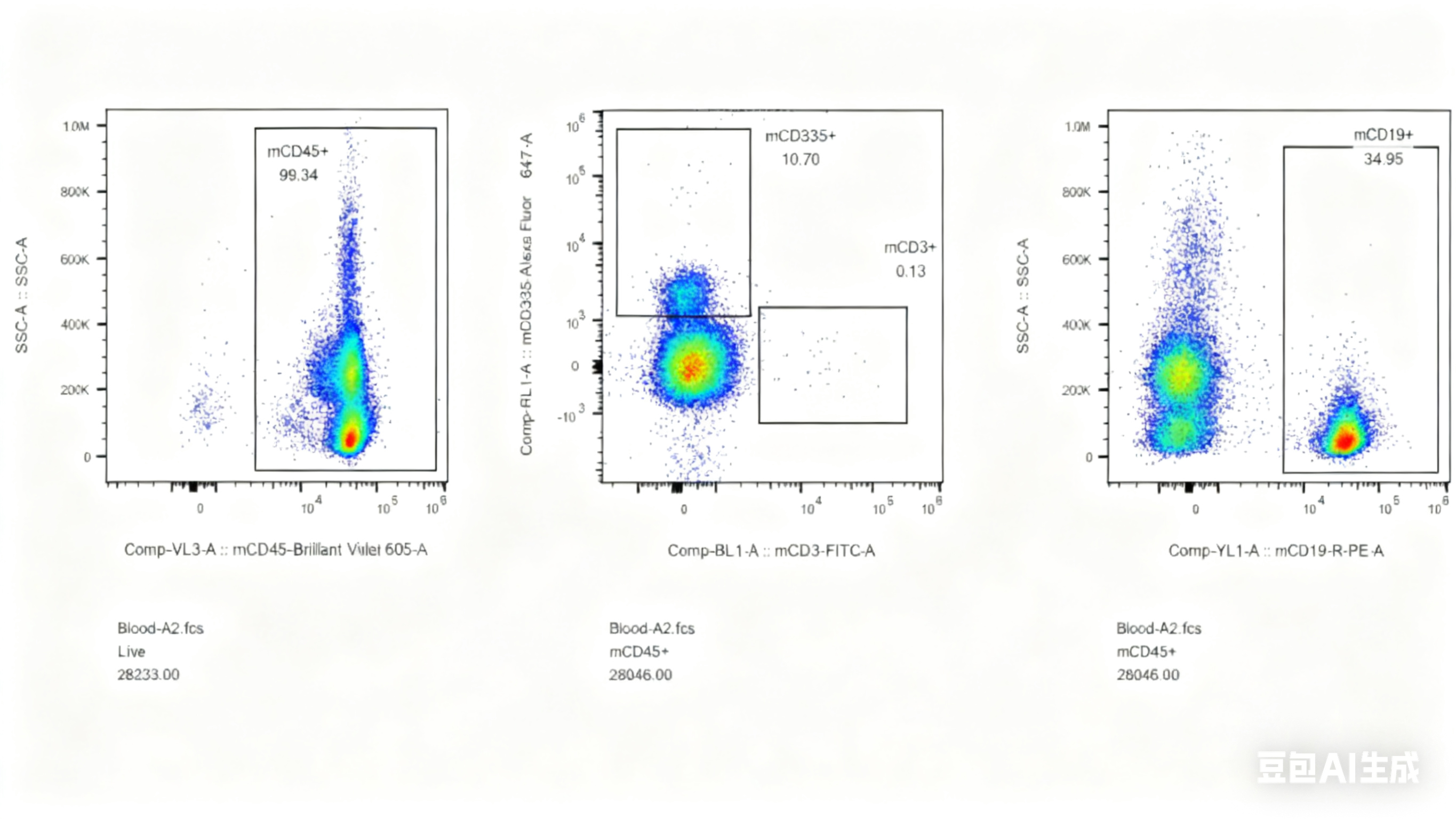
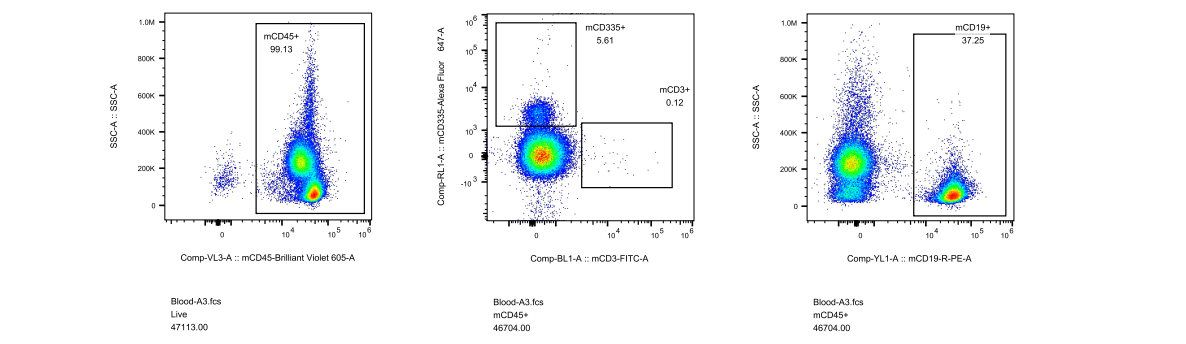
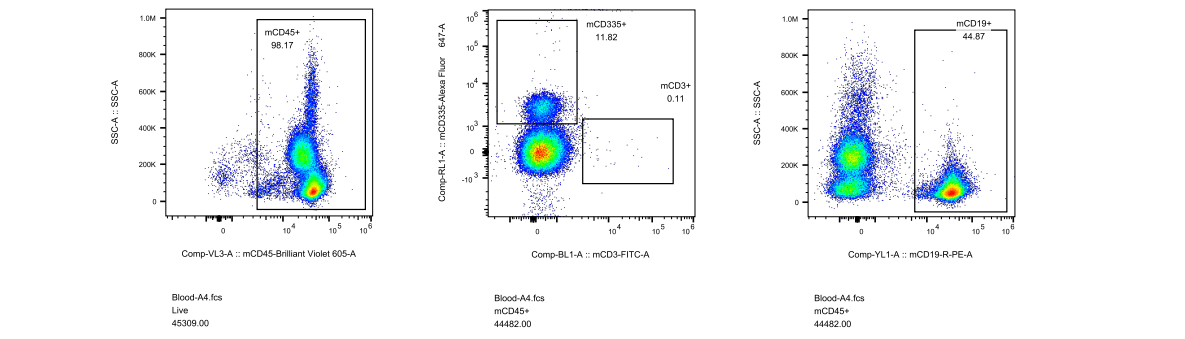

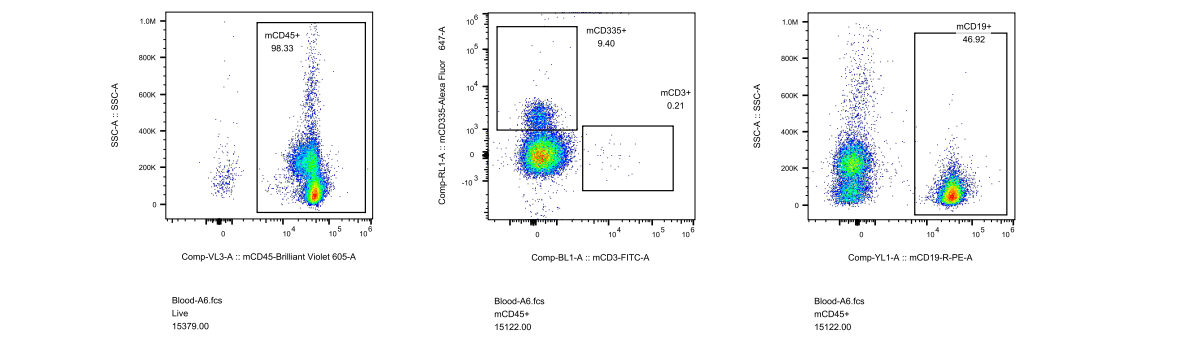
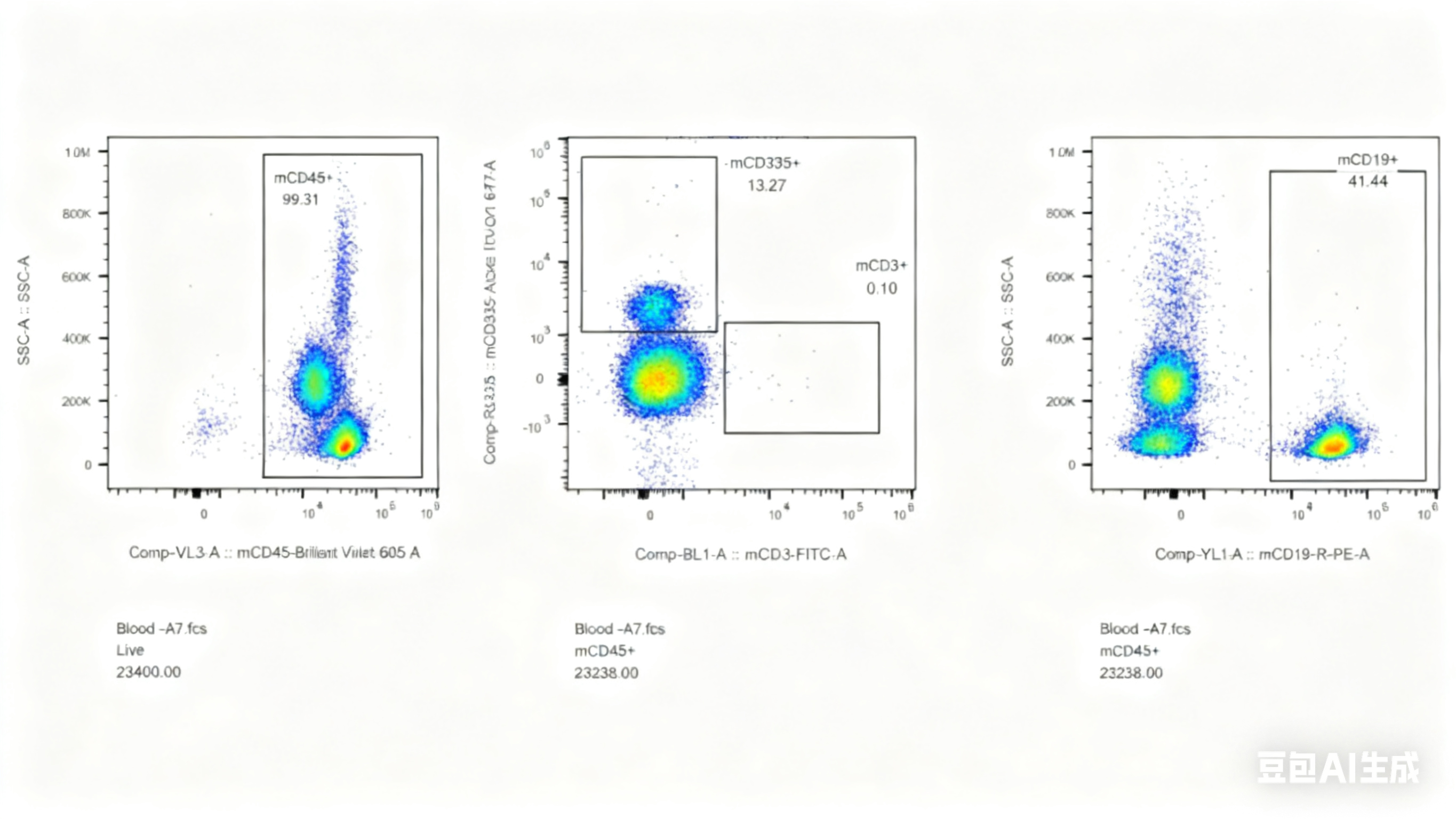
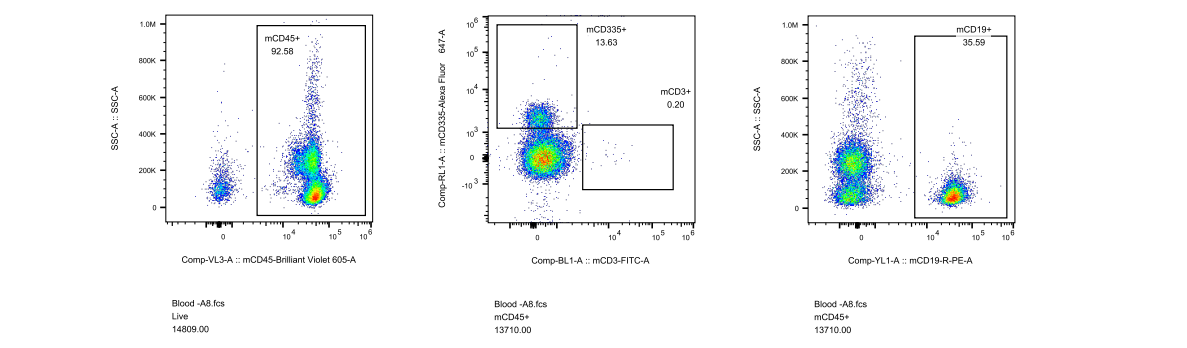
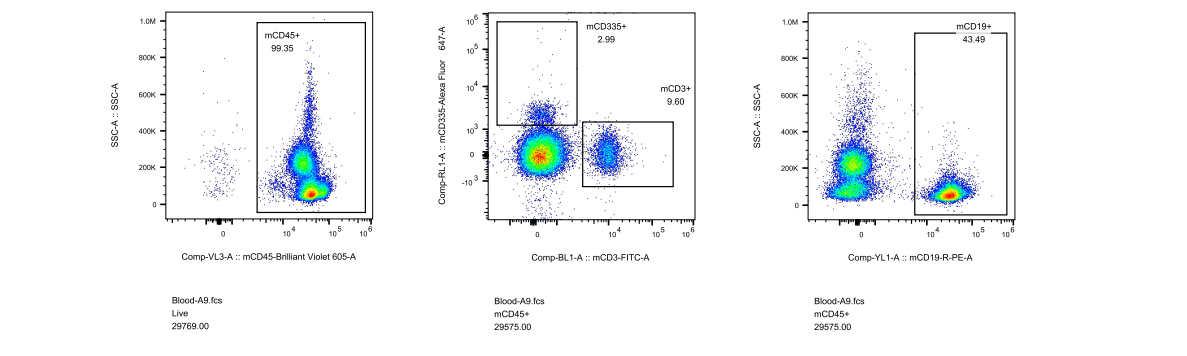
图4. 长毛BALB/c-Nude及无明显毛发BALB/c-Nude流式检测结果
(A1-A5为长毛BALB/c-Nude、A6-A8为无明显毛发BALB/c-Nude、A9为BALB/cJGpt对照)
用裸鼠进行荷瘤实验,关键因素有哪些?
影响成瘤的因素较多,与细胞系本身特性、细胞状态、细胞传代次数、支原体污染与否、接种部位、接种量、小鼠的周龄、性别、适应性饲养及饲养环境等都息息相关,当出现荷瘤效果不理想时,需要针对性的逐一分析。以皮下CDX接种为例,小编总结了影响实验效果的关键质控点:
1.实验方案设计
文献调研,首先了解细胞系适宜接种的小鼠及性别等模型信息;其次了解常见接种位点、接种剂量、是否需要添加基质胶等接种条件。建议正式实验之前开展预实验,进行成瘤测试,收集数据以摸索最佳接种条件。可浏览以下网页,查看药康体系下的成瘤数据:
https://cn.gempharmatech.com/service/cdx.html
2. 小鼠环节
小鼠在运输过程中会产生应激反应,使小鼠出现一系列的病理生理学变化,这些变化会增加某些实验误差,因此在接到动物后应尽量避免立即进行实验,建议让动物有1~2周的适应期。免疫缺陷小鼠对饲养环境的要求高,必须饲养在SPF级屏障设施内,且与免疫正常小鼠饲养在不同房间。如果环境设施不达标,有可能会间接影响肿瘤模型的制备。裸鼠长期暴露在弱抗原的刺激下,NK等免疫细胞的活力逐步增强,会导致裸鼠对肿瘤的非特异性免疫力增强。
3. 细胞环节
细胞状态:建议取处于对数期生长的细胞进行接种,避免体外过度传代影响细胞状态。
支原体检测:接种前对细胞进行支原体检测。支原体污染极为常见,会改变培养细胞的代谢、增殖特征及形态等,从而影响肿瘤生长和结果的可重复性[4]。
细胞活率:细胞活力是影响肿瘤形成的重要原因,建议接种前后均进行细胞活率检测,细胞活率90%以上为宜,确保接种过程中细胞活率没有明显降低。
细胞浓度:以活细胞数量为准,调整细胞浓度。
4. 接种环节
细胞混匀:接种前和接种过程中均需注意混匀细胞,建议接种过程中每次吸取细胞均要上下颠倒混匀,每次接种2笼小鼠使用枪头轻轻吹打混匀。
添加基质胶(如需要):建议提前一天将基质胶置于碎冰盒中,放置于 4℃冰箱过夜融化;基质胶混匀,动作轻柔,避免过多气泡产生,且整个过程需放置在碎冰中。
皮下注射:使用75%酒精消毒接种区域皮肤,进针角度小于30°,进针过程中不要挑针,使针头平稳的在皮下移动,直至三分之一左右的针头进入小鼠皮下,此时针尖位置在接种点附近缓慢注射细胞悬液;注射后,针头轻微旋转,缓慢抽出。操作结束后注意观察注射部位是否有出血,小鼠是否活动异常等情况。
注意:整个接种过程建议在2h内完成;接种时细胞悬液应一直置于4℃环境中,使其维持恒定温度保证细胞活力。
5. 观测环节
肿瘤体积计算公式为:肿瘤体积(mm3)=0.5×肿瘤长径×肿瘤短径2。由于不同实验人员测量之间可能存在误差,建议同一个实验中由同一个研究人员测量所有小鼠的肿瘤大小,以尽量避免肿瘤的测量误差。以下为我司肿瘤观察测量方式:
· 小鼠保定,观察接种位置的肿瘤形态
为防止肿瘤在保定过程中被拉扯变形(下图1B、1C、2B、2C),保定时应使肿瘤周边皮肤相对松弛(下图1A、2A),同时注意保定小鼠头部及鼠尾,防止其回头咬伤实验人员。
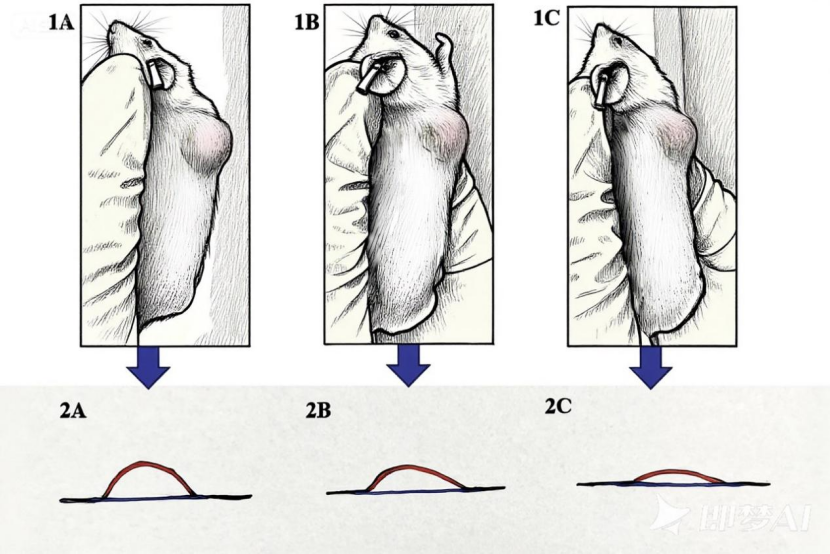
图4. 以NCG小鼠为例,不同保定力度下肿瘤外观及形态示意图(A.松弛状态,B.拉伸状态,C.过度拉伸状态)
· 酒精棉擦拭,清晰肿瘤形态
使用75%酒精棉球擦拭肿瘤表面及周边皮肤,使肿瘤轮廓更加清晰(图5)后进行肿瘤测量。注意:不应使用过于湿润的酒精棉球,以擦拭肿瘤表面后无明显液体为宜。测量时以肿瘤恰可以从游标卡尺外测量爪中通过的读数为准。
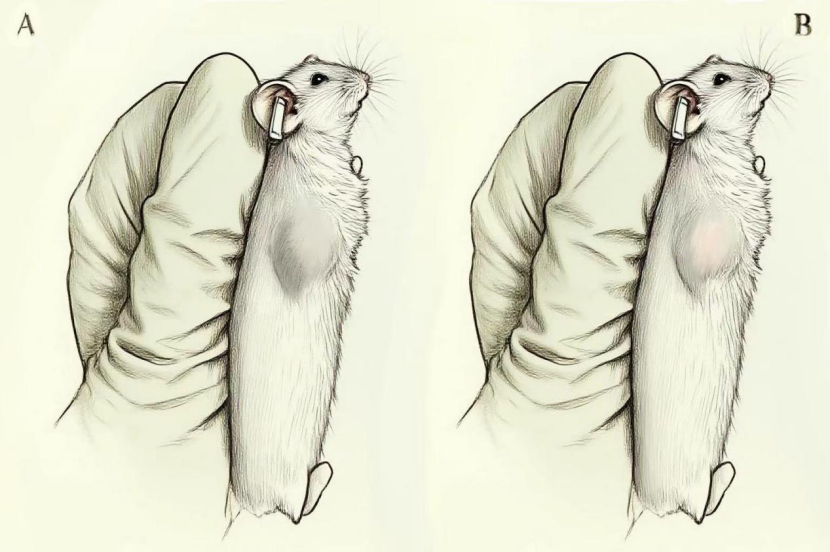
图5. 以NCG小鼠为例,酒精棉球擦拭后肿瘤形态(A.未擦拭,B.酒精棉球擦拭后)
通过以上介绍,相信大家都有了更清晰的认识,裸鼠长毛其实是一种正常的生理现象,这些"叛逆"的小毛发只是Foxn1基因突变带来的外表特征,不代表免疫缺陷能力的恢复。严格把控实验细节,方能一路披荆斩棘。
参考文献
[1] Nowell CS, Bredenkamp N, Tetélin S, et al. Foxn1 regulates lineage progression in cortical and medullary thymic epithelial cells but is dispensable for medullary sublineage divergence. PLoS Genet. 2011;7(11):e1002348.
[2] Flanagan SP. 'Nude', a new hairless gene with pleiotropic effects in the mouse. Genet Res. 1966;8(3):295-309.
[3] Eaton GJ. Hair growth cycles and wave patterns in "nude" mice. Transplantation. 1976;22(3):217-222.
[4] Stribbling SM, Ryan AJ. The cell-line-derived subcutaneous tumor model in preclinical cancer research. Nat Protoc. 2022;17(9):2108-2128.

