体外药效系列之:ADC药物体外功能评价平台
抗体 - 药物偶联物(ADCs)是治疗实体瘤和血液系统恶性肿瘤极具前景的创新型治疗复合物。与治疗性单克隆抗体不同,ADCs借助单克隆抗体与细胞毒性有效载荷的连接,可向靶向癌细胞精准递送强效毒素。
随着ADC药物开发进程的不断加快以及应用场景的持续拓展,其研发也面临着更高的挑战。一方面,需进一步增强有效载荷的细胞毒性与靶向精准度,减少对正常细胞的损害;另一方面,要优化抗体与毒素的偶联方式,确保药物在体内的稳定性和药代动力学特性良好,同时还要探索更广泛的作用靶点以及联合治疗策略,以此应对肿瘤的异质性和耐药性问题。在ADC药物研发的早期阶段,全面且深入地探究药物的作用机制与潜力,能够有效提升研发效率、降低后续研发风险,推动创新ADC药物更快速地从实验室迈向临床应用,为攻克癌症这一医学难题注入更强劲的动力。
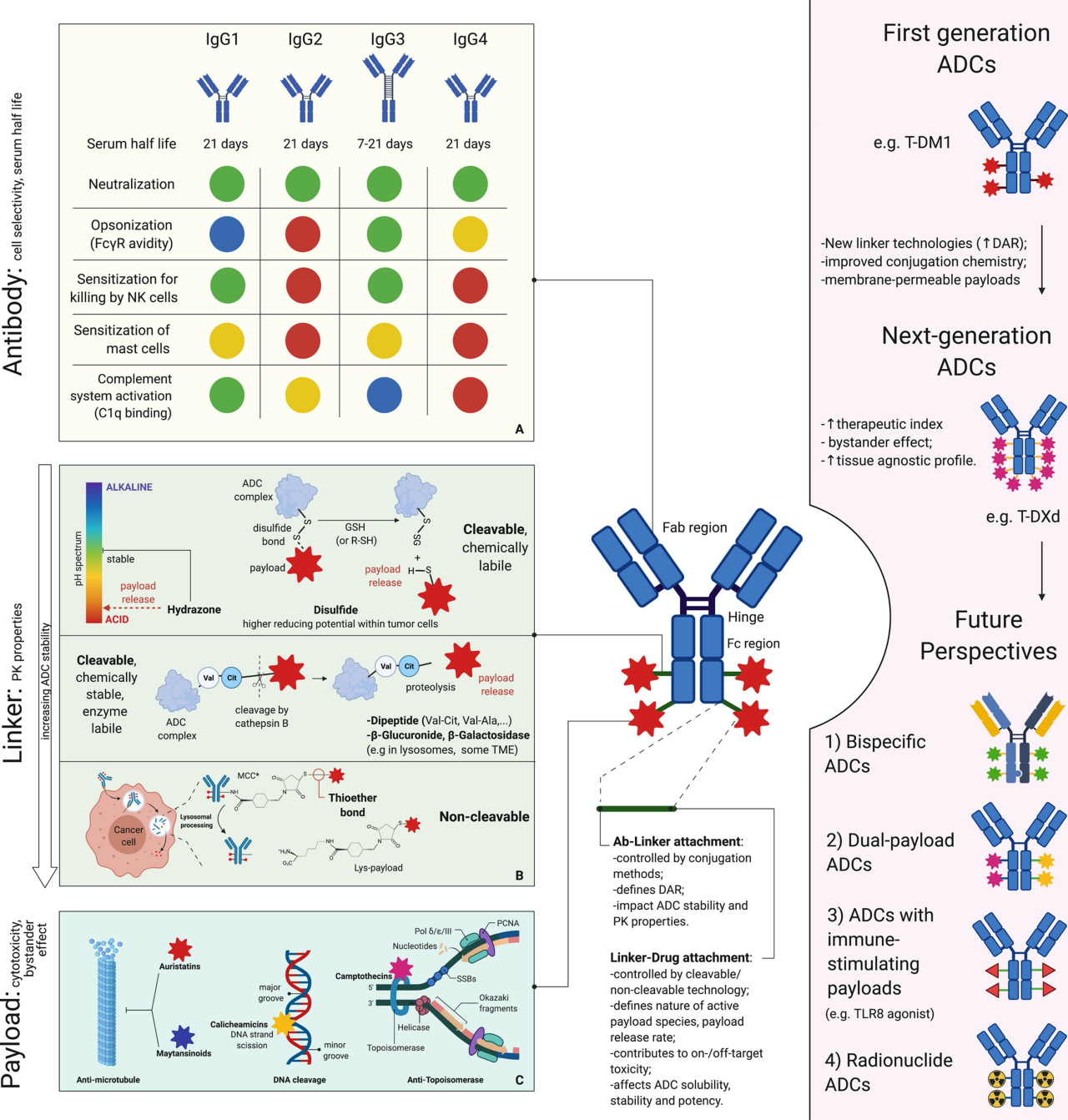
图1. 新型抗体 - 药物偶联物(ADCs)的主要特征及其对未来药物研发的潜在意义[1]
案例一:抗原表达
目的:评估8种细胞系中c-Met和HER2的表面表达情况,以确定其是否适合作为ADC的靶向对象。
方法:流式细胞术分析。
结果:c-Met和HER2在肿瘤细胞中广泛分布,这为双靶点ADC或联合疗法提升癌症治疗效果提供了良好潜力。
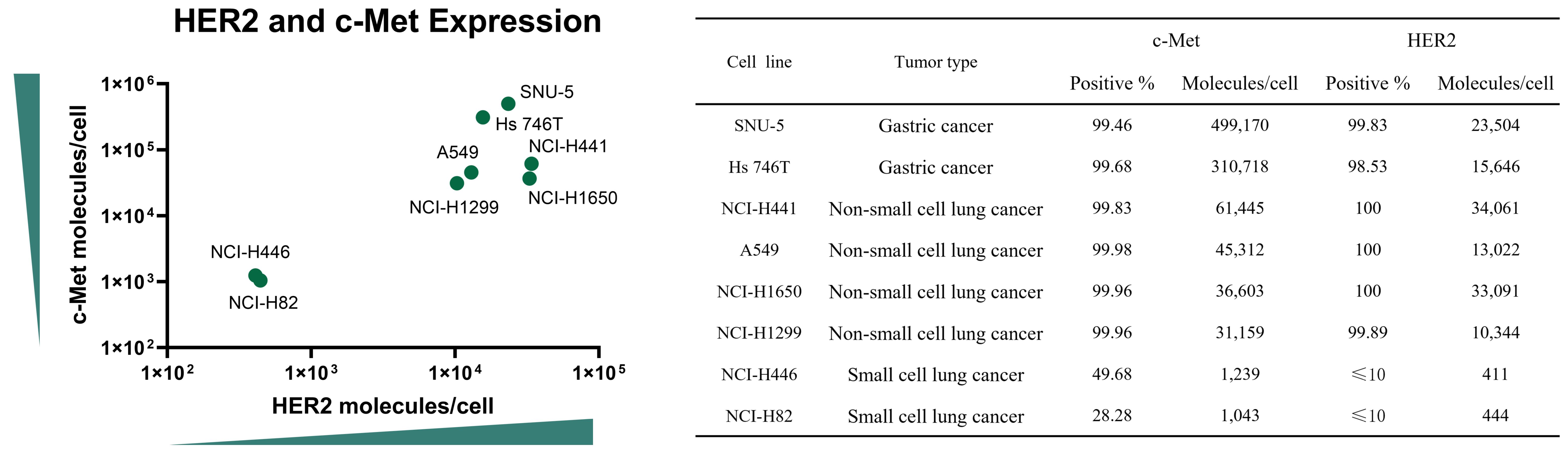
图2. 8种细胞系中HER2和c-Met的表面表达
案例二:细胞结合试验
目的:评估ABBV-399(c-Met ADC药物)与肿瘤细胞上c-Met的结合亲和力。
方法:流式细胞术分析。
结果:ABBV-399对所有三种肿瘤细胞系均显示出结合能力,其结合特征与Telisotuzumab(c-Met抗体)相似。

图3. ABBV-399在不同癌细胞系中的结合试验
案例三:细胞毒性试验
目的:筛选多种肿瘤细胞系,找出对ABBV-399介导的细胞毒性高度敏感的细胞系。
方法:CellTiter-Glo(CTG)试验。
结果:ABBV-399对四种肿瘤细胞系表现出强效的细胞毒性,其疗效与c-Met过表达水平密切相关。值得注意的是,在SNU-5细胞系中,与游离的细胞毒性有效载荷(MMAE)相比,ABBV-399展现出显著更强的抗增殖作用。
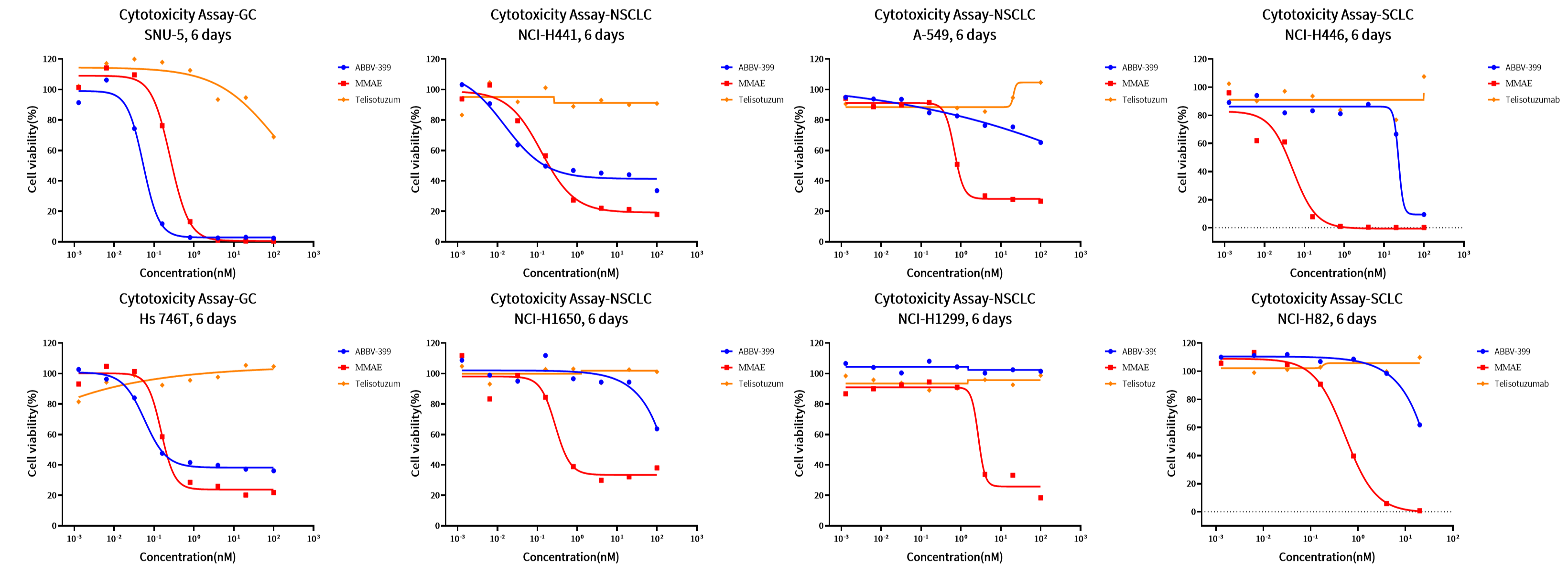
图4. ABBV-399对肿瘤细胞系的量效曲线
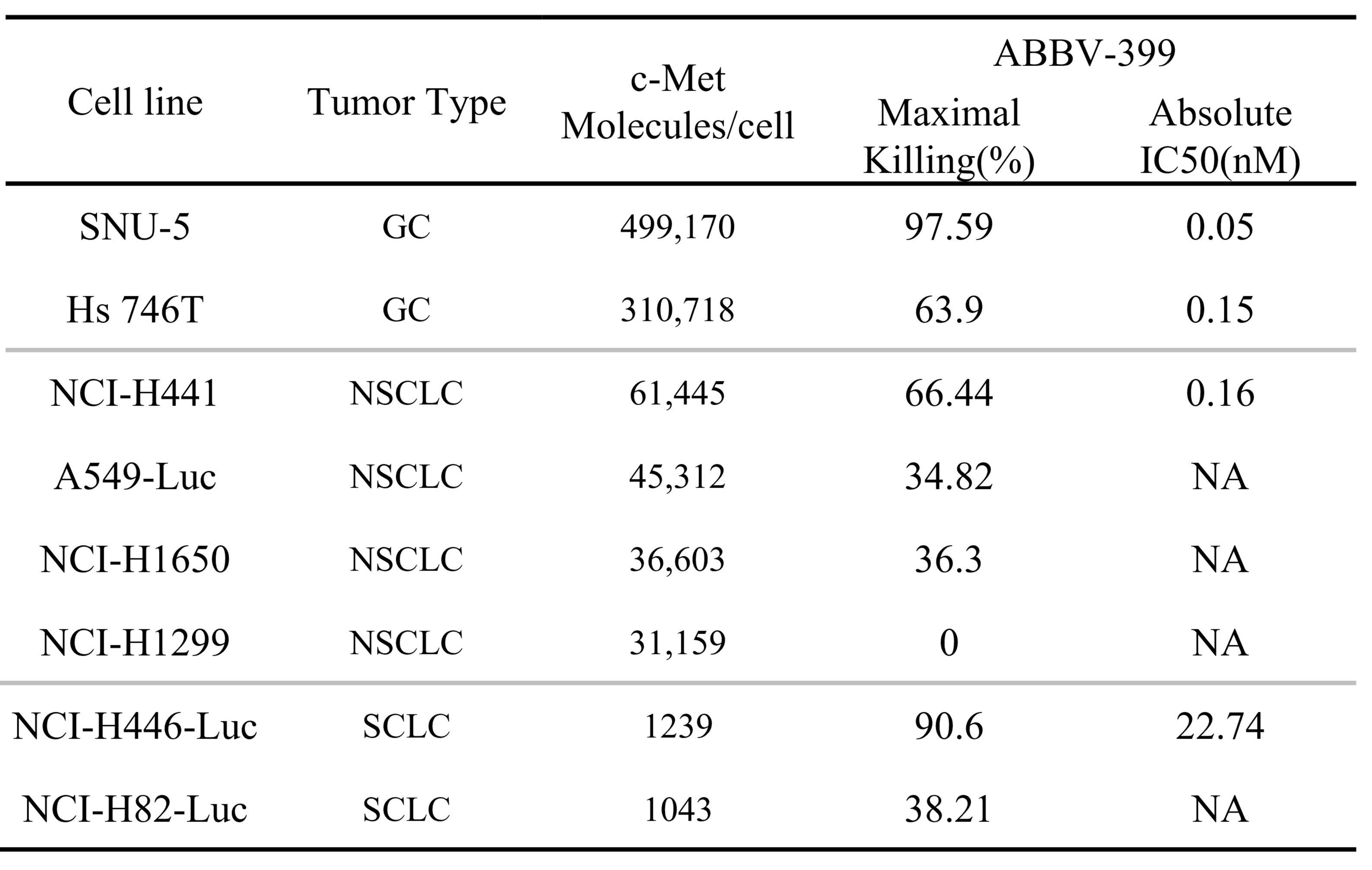
表 1. 肿瘤细胞体外c-Met表达及对ABBV-399的敏感性
案例四:内吞作用
目的:使用pH敏感型荧光染料pHrodo™评估ABBV-399细胞水平内吞作用。
方法:流式细胞术分析。
结果:ABBV-399与Telisotuzumab表现出相似的内化效果,且内化比例与时间呈正相关。在c-Met阳性的NCI-H1650细胞中检测到较低的内化信号,这或许能解释ABBV-399与该细胞结合却未发挥细胞毒性的现象。
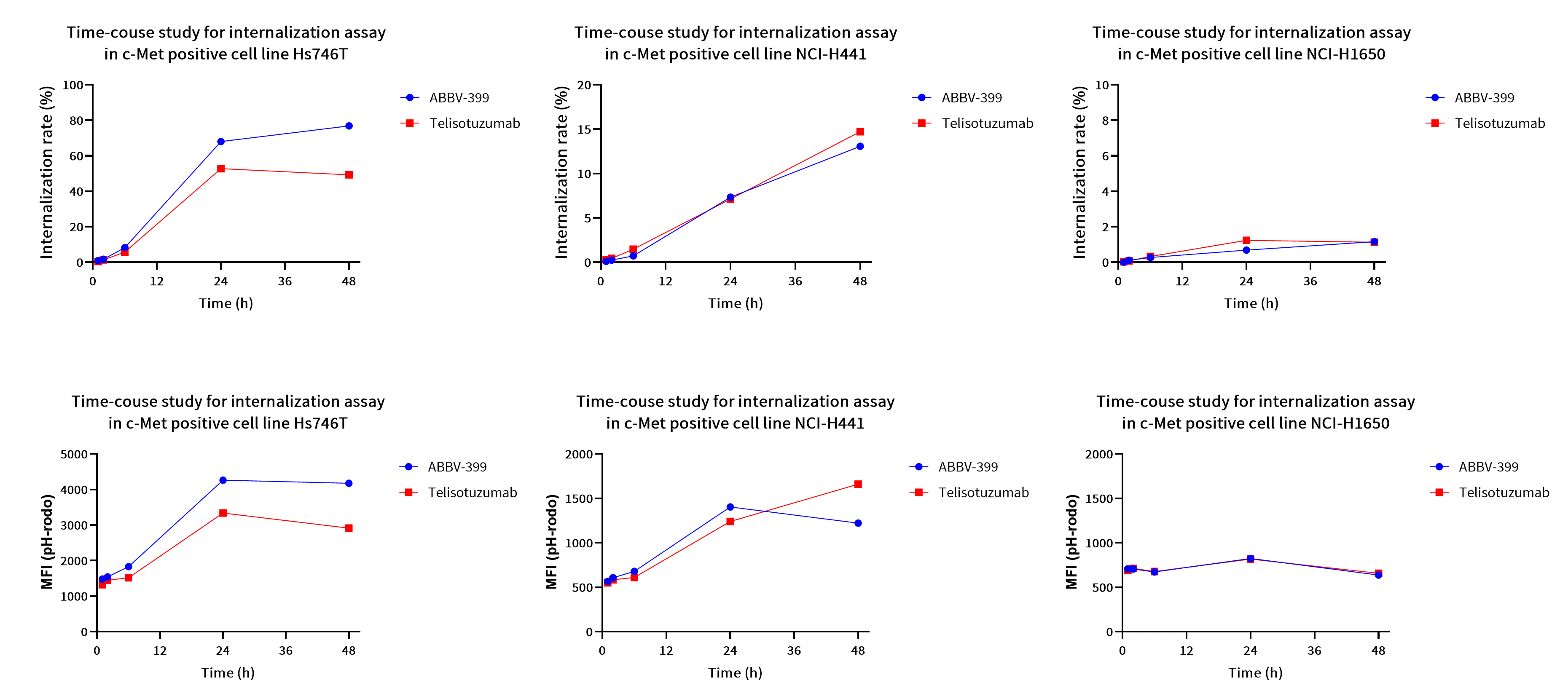
图5. ABBV-399的内化动力学
案例五:细胞周期和凋亡试验
目的:评估DS-8201a对靶细胞SK-BR-3细胞周期和凋亡的影响。
方法:流式细胞术分析。
结果:处理48小时后,与对照组相比,DS-8201a组S期细胞比例显著增加,有效载荷通过抑制拓扑异构酶I使细胞周期停滞在S期(图 6)。与对照组相比,DS-8201a组凋亡细胞比例显著上升,有效载荷可通过细胞周期依赖或非依赖的方式诱导细胞凋亡(图 7)。
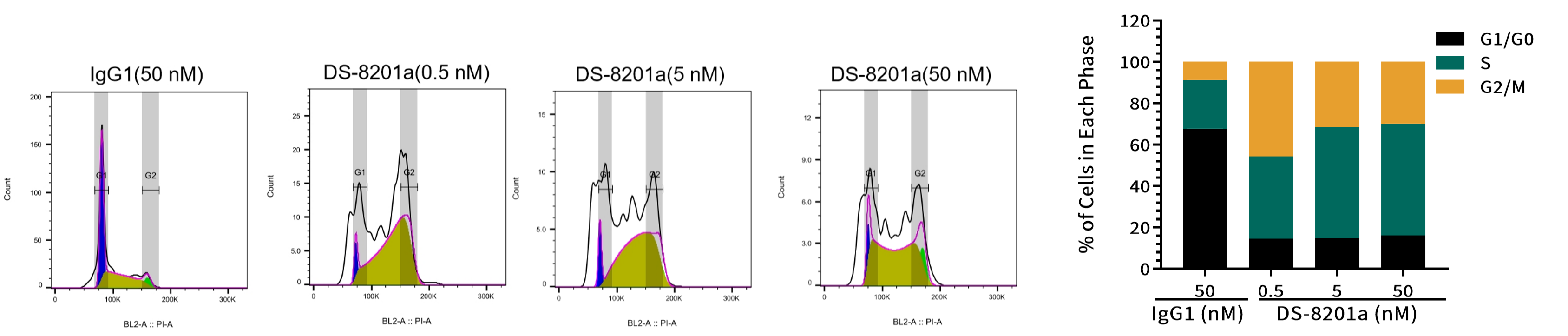
图6. 不同浓度DS-8201a对靶细胞SK-BR-3细胞周期的影响
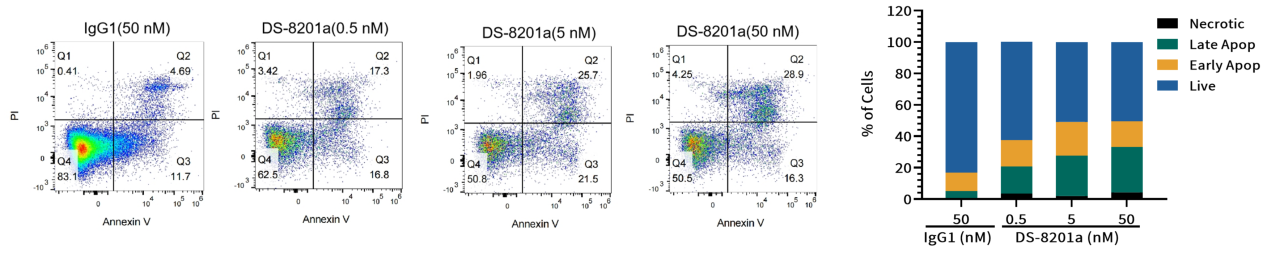
图7. 不同浓度DS-8201a在靶细胞SK-BR-3中诱导的凋亡
案例六:体外共接种条件下的旁观者杀伤作用(流式细胞术,FACS)
目的:评估DS-8201a对HER2阳性和HER2低表达肿瘤细胞的旁观者效应。
方法:流式细胞术分析。
结果:DS-8201a对HER2阳性的SK-BR-3细胞具有直接细胞毒性,且在共培养中对抗原阴性的MDA-MB-468细胞表现出旁观者杀伤效应。
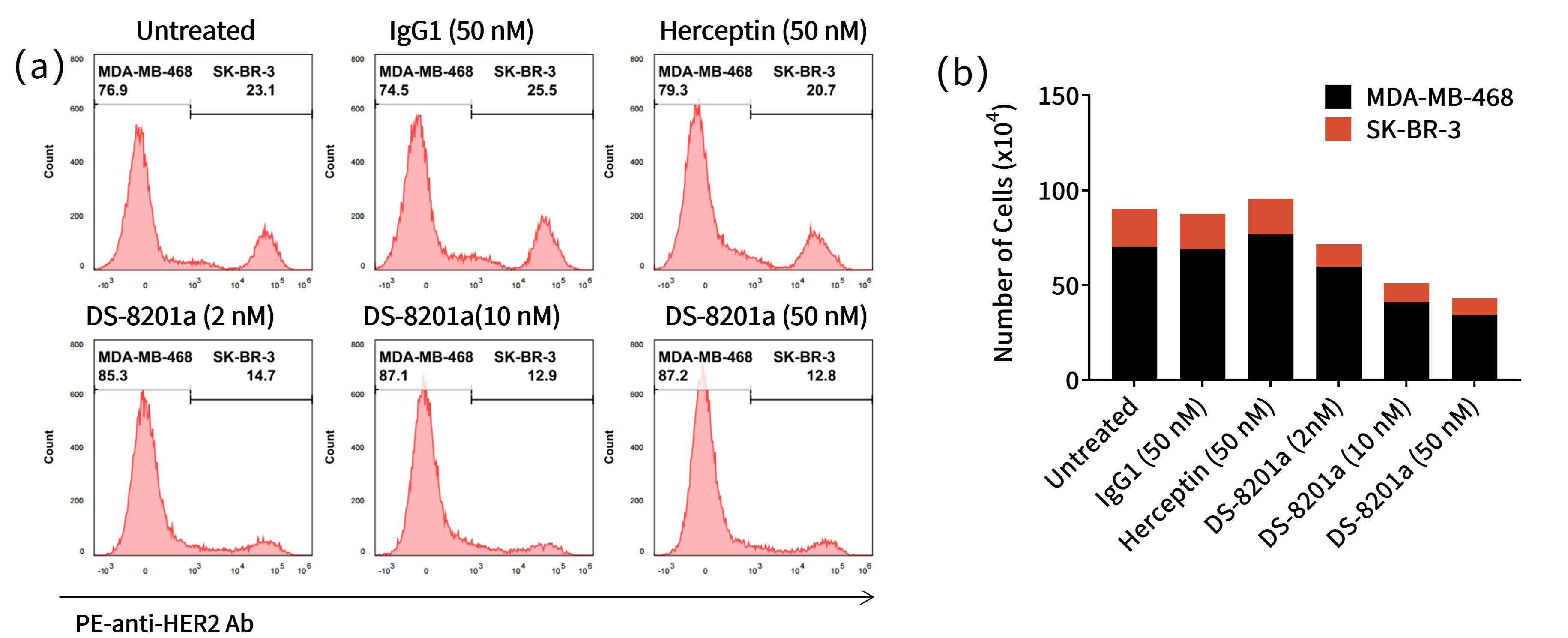
图8. ABBV-399的体外旁观者杀伤效应
(a)流式细胞术的群体分析(b)DS-8201a处理后存活的SK-BR-3和MDA-MB-468细胞数量
案例七:体外共接种条件下的旁观者杀伤作用(荧光素酶报告细胞)
目的:将不同水平c-Met表达的SNU-5细胞(ADC靶细胞)与c-Met低表达的荧光素酶阳性细胞(报告细胞,A549-NSCLC和NCI-H82-SCLC)以2:1的比例混合,并用ABBV-399处理。孵育6天后,测定荧光素酶活性以评估报告细胞情况,测定CTG活性以评估SNU-5细胞情况。
方法:荧光素酶报告细胞和CTG试验。
结果:在SNU-5(c-Met表达细胞)与A549-luc或NCI-H82-luc报告细胞(均为c-MET低表达)的共接种体系中,ABBV-399以浓度依赖的方式降低了报告细胞混合物的活力。这表明 ABBV-399介导了浓度依赖的旁观者杀伤效应。
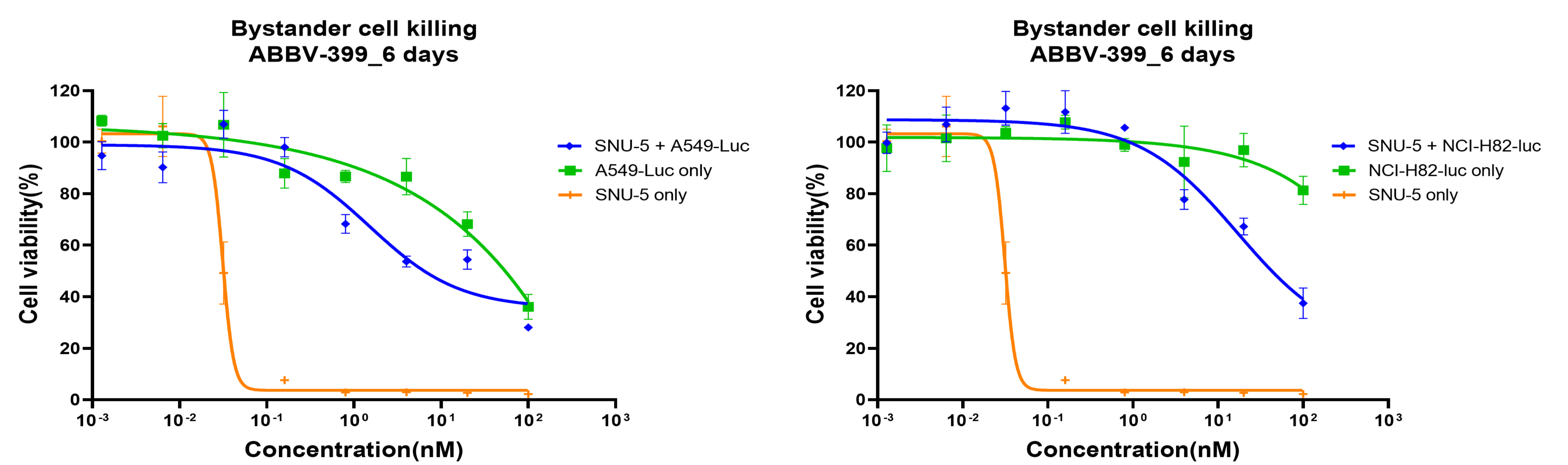
图9. ABBV-399的体外旁观者杀伤效应
集萃药康(GemPharmatech)的ADC评估平台能够实现从抗原分析、结合亲和力到内化效率和肿瘤细胞杀伤等方面的全面体外评估,可系统开展ADC药物全方位评估,为候选药物的筛选与优化提供强有力的技术支持,提升临床前研究成功率。

