逆龄黑科技:老龄鼠模型解锁抗衰老研究新纪元
衰老是生命过程中复杂的生物学现象,也是心血管疾病、神经退行性疾病等众多慢性疾病的核心风险因素。随着全球人口老龄化进程的加速,深入解析衰老机制并开发有效干预策略已成为生命科学领域的研究焦点。近年来,该领域涌现出多项突破性进展,涵盖从细胞衰老清除、免疫靶向干预到小分子代谢调控及联合用药策略等多个层面。在这些前沿探索中,老龄鼠模型作为连接基础机制研究与临床转化的关键桥梁,发挥了不可或缺的作用。
图1. 监测年龄及相关特征的新技术[1]
衰老研究的最新突破
随着对衰老机制的深入探索,衰老研究正逐步迈向精准干预的新阶段。2025年,三项具有里程碑意义的突破为抗衰老研究开辟了新方向。
25HC:逆转血管僵硬
主动脉僵硬是衰老相关心血管疾病的重要预警指标,其关键驱动因素之一是细胞衰老。2025年《Aging Cell》发表的研究揭示,内源性胆固醇代谢物25-羟基胆固醇(25HC)可靶向CRYAB蛋白清除血管衰老细胞,有效逆转主动脉僵硬。

研究采用22-26月龄的p16-3MR老龄小鼠模型。结果显示,短期(5天)25HC处理显著降低了主动脉搏波速度(PWV)(从366±5 cm/s降至349±5 cm/s)。机制研究发现,25HC通过抑制CRYAB蛋白表达(主动脉CRYAB蛋白水平降低38%, p=0.028),下调衰老细胞抗凋亡通路(SCAPs),减少胶原蛋白-1沉积(降低42%)并增加α-弹性蛋白含量(增加59%),最终显著改善血管壁结构刚度(25HC实验组弹性模量1832±83 kPa远低于对照组2928±257 kPa, p=0.003[2]。
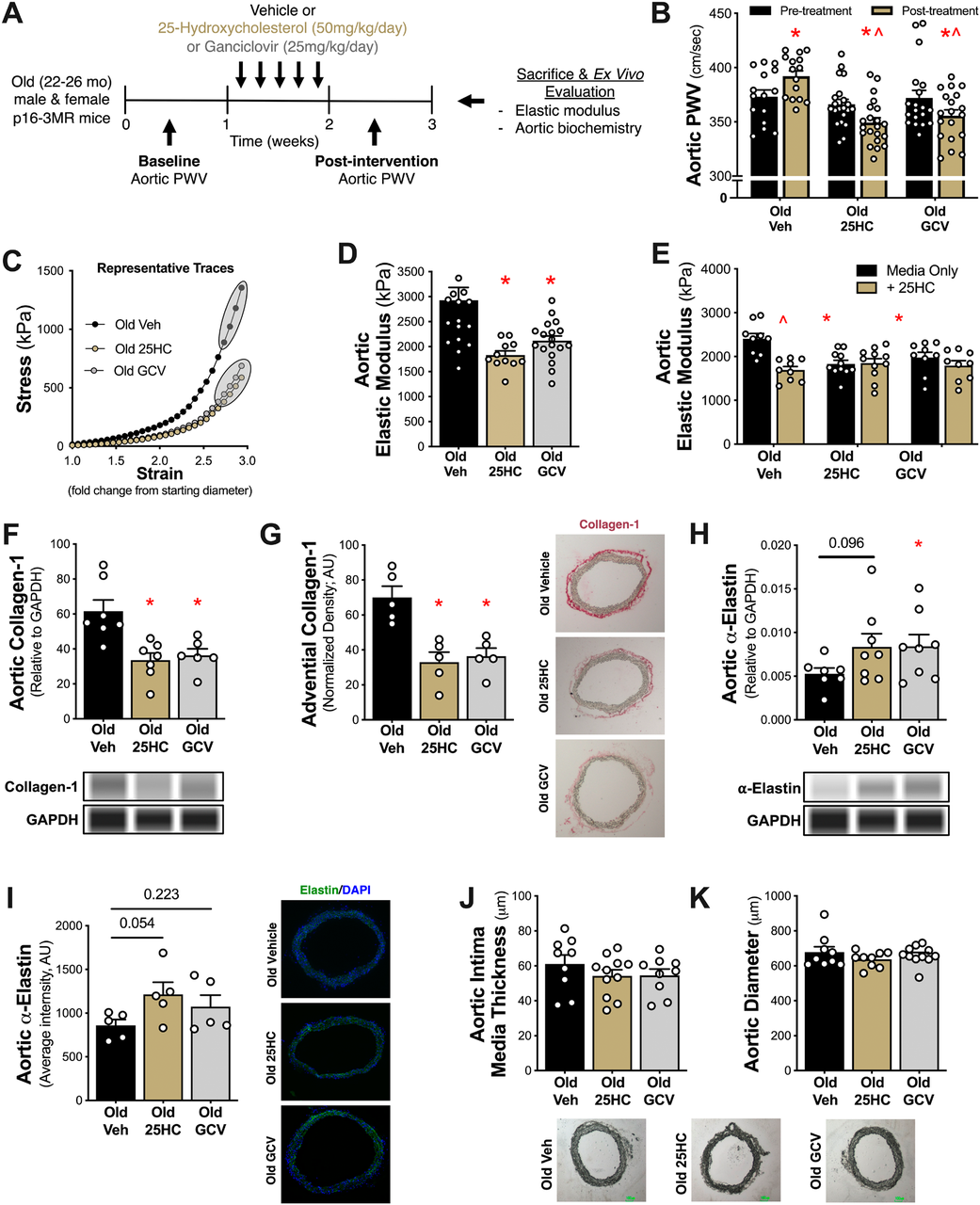
图2. 25-羟基胆固醇 (25HC) 通过抑制血管细胞衰老和重塑血管壁来降低老年小鼠的主动脉僵硬程度
CD38:代谢与免疫的 “衰老枢纽”
CD38作为NAD+降解酶,在衰老过程中通过破坏代谢稳态和加剧慢性炎症,加速组织功能衰退。2025年《Aging Cell》的一项开创性研究首次证实,CD38靶向肽疫苗可通过免疫途径选择性清除CD38+衰老细胞,有效改善小鼠衰老表型。

该研究在12月龄C57BL/6老龄小鼠中进行,疫苗(肽序列2ANYEFSQV9)成功诱导了特异性Th1免疫反应,有效降低了CD38+衰老细胞水平。功能评估显示,疫苗接种显著提升了小鼠体能:转棒测试最大速度提高,握力增强,悬挂耐力延长。认知功能也得到改善:Morris水迷宫实验中平台潜伏期缩短,新物体识别实验探索时间增加。在代谢层面,疫苗使肝脏NAD+/NADH比值升高,改善血糖耐受性。同时,β-半乳糖苷酶(SA-β-gal)阳性的肝脏衰老细胞减少,衰老相关基因p21 mRNA水平降低[3]。
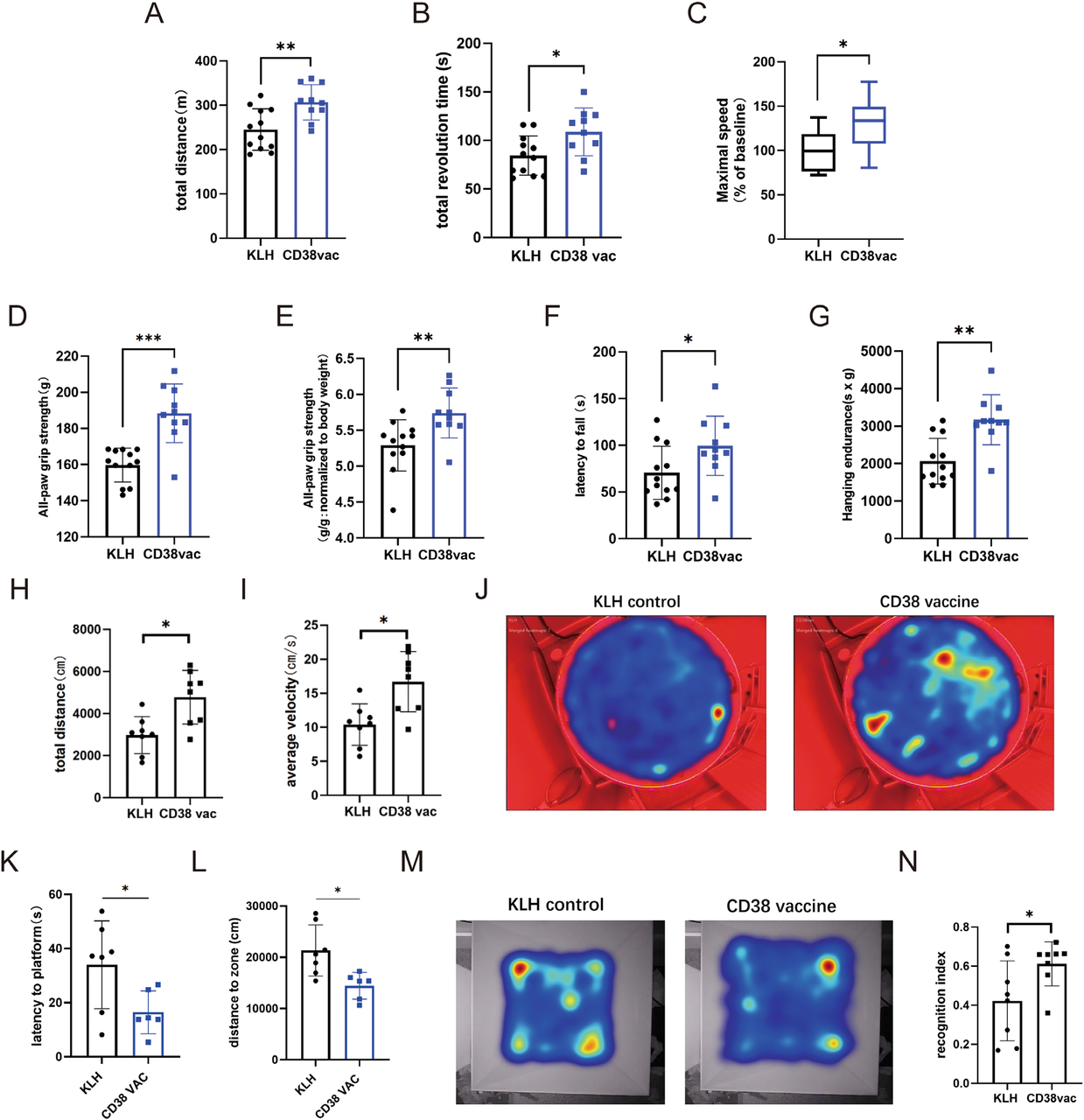
图3. CD38疫苗可预防自然衰老小鼠的身体和认知能力衰退
曲美替尼+雷帕霉素:从单靶点到联合调控
鉴于衰老涉及复杂网络调控,单一靶点干预往往效果有限,联合调控多通路成为新策略。2025年《Nature Aging》研究表明,MEK抑制剂曲美替尼(trametinib)与mTOR抑制剂雷帕霉素(rapamycin)联合使用可显著延长小鼠寿命。

该研究利用6月龄C3B6F1小鼠模型进行长期干预。结果显示,单药曲美替尼使雌性中位寿命延长7.2%,雄性延长10.2%;单药雷帕霉素使雌性中位寿命延长17.4%,雄性延长16.6%。而联合治疗展现出显著的协同效应:使雌性中位寿命延长34.9%,雄性延长27.4%,且最大寿命同步提升(雌性32.4%,雄性26.1%)[4]。
联合治疗的优势不仅体现在寿命延长,更体现于对多系统衰老表型的广泛改善:
肿瘤抑制: 显著降低肝脏肿瘤发生率,并在雄性小鼠中降低脾脏肿瘤发生率;
神经保护: 通过18F-FDG PET/CT成像发现,联合治疗完全阻断了年龄相关的脑葡萄糖摄取增加,并显著减少纹状体活化小胶质细胞密度;
炎症缓解: 有效降低血浆中关键促炎蛋白水平(TNF-α、IL-17a、IL23r等),并改善肾脏炎症状况[4]。
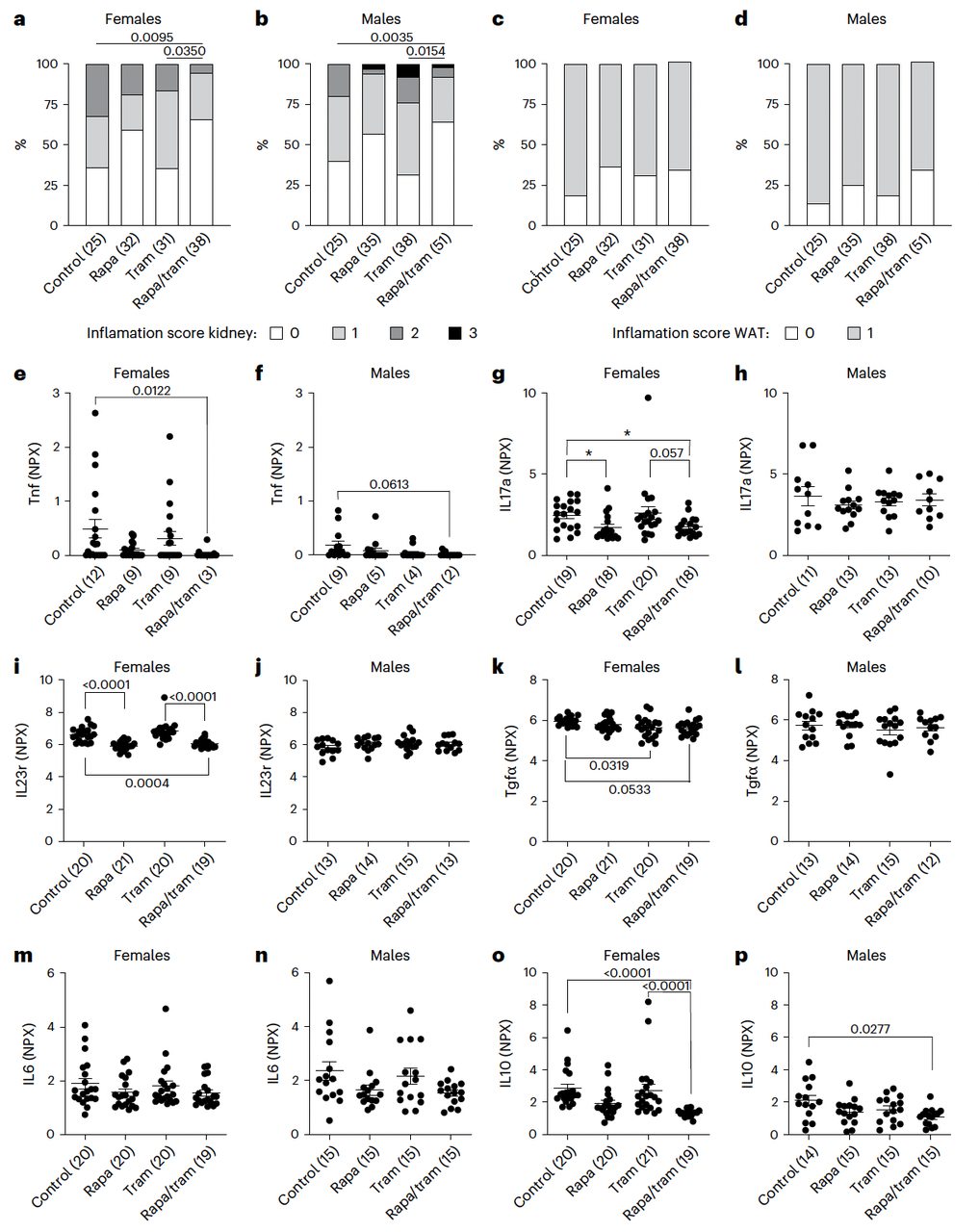
图4. 实验表明,曲美替尼+雷帕霉素联合治疗可减少外周炎症
老龄鼠模型:衰老研究的标准化基石
上述突破性研究的关键发现,均高度依赖标准化老龄动物模型上的严谨验证。其中,C57BL/6老龄鼠凭借其遗传背景清晰(近交系纯度>99.9%)、衰老表型稳定且可重复性强,已成为国际公认的衰老研究“黄金标准”模型。
集萃药康提供的C57BL/6JGpt老龄鼠品系(品系编号T065274)经过系统表型验证,建立了6-24月龄的动态数据库,支持研究者根据实验需求进行定制化月龄与性别选择,为衰老机制深度解析及干预策略效能评估提供坚实可靠的标准化工具。
该模型在18月龄后呈现典型的衰老特征,包括:体重逐渐下降、高频听力损失、运动能力衰退、血液指标异常(红细胞计数降降低、血小板计数升高、血红蛋白浓度(HGB)显著降低等)以及多器官衰老病理变化(如肝脏炎性浸润、肾脏纤维化、SA-β-gal阳性细胞率升高)。
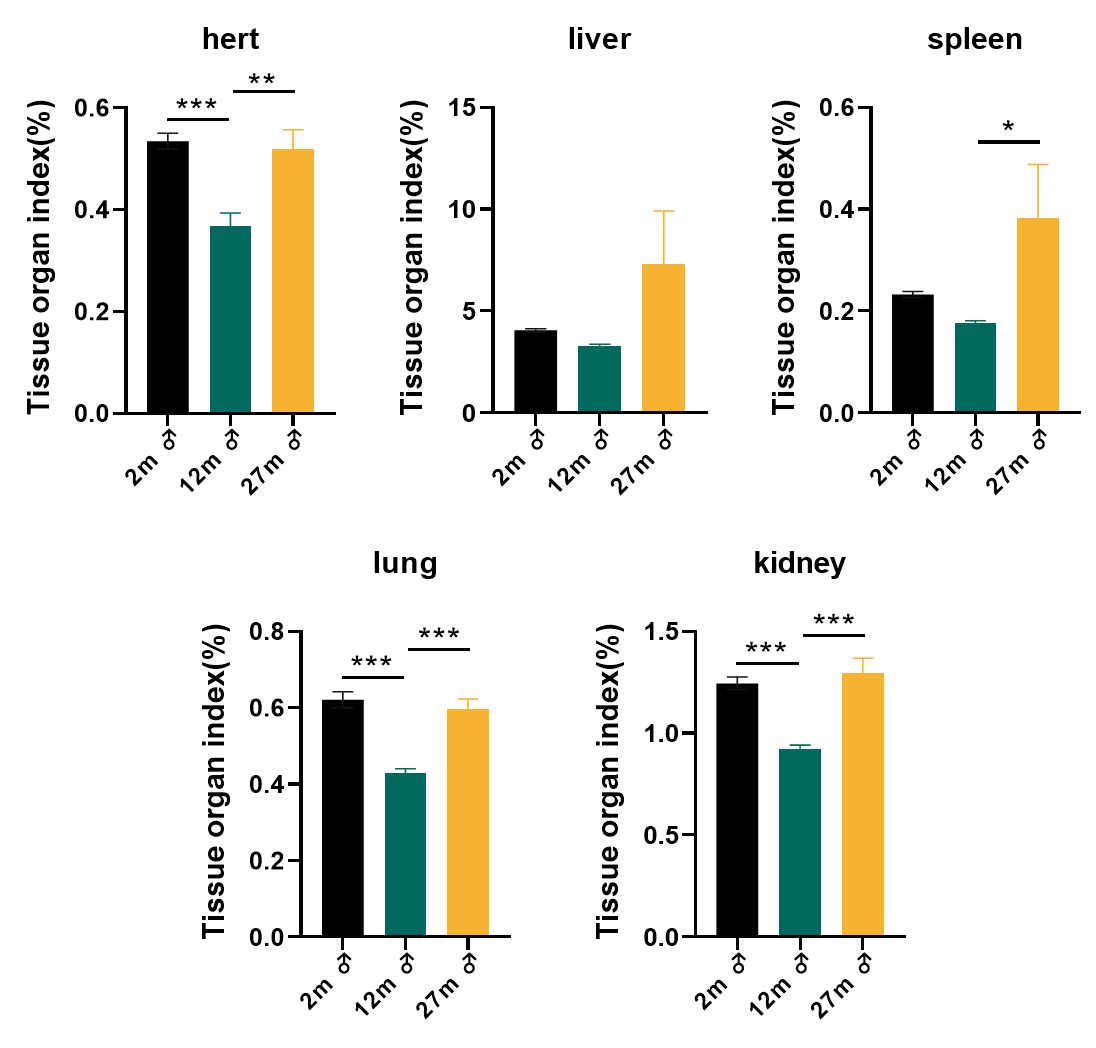
图5. C57BL/6JGpt 雄鼠主要脏器(心、肝、脾、肺、肾)指数随年龄变化情况(n≥14)
结语
2025年衰老研究领域在靶向干预策略上取得了令人瞩目的进展。从25HC精准清除血管衰老细胞、CD38疫苗通过免疫疗法重塑代谢与炎症稳态,到曲美替尼与雷帕霉素的联合用药展现出协同增效的强大潜力,这些突破共同标志着抗衰老研究已从探索单一机制迈向协同调控多重衰老通路的精准干预新阶段。
这些成就的取得,高度依赖于C57BL/6JGpt等标准化老龄动物模型所提供的可靠、可重复的研究平台。这些模型是连接基础发现与临床转化的不可或缺的桥梁,其价值在上述每一项机制的解析和验证中都得到了充分体现。
参考文献:
[1] Ageing research reviews vol. 62 (2020): 101094.
[2] Aging Cell, vol. 24,8 e70118. 22 May. 2025
[3] Aging Cell, e70147. 25 Jun. 2025
[4] Nature aging vol. 5,7 (2025): 1249-1265.

