Cre-Loxp 系统基因敲除应用与鉴定实操指南
Cre-Loxp 系统是基因功能研究中实现定点敲除的核心工具,其应用可靠性直接依赖于规范的模型鉴定与对系统特性的精准把握。本文基于实验实操经验,系统梳理 Flox 模型鉴定、CKO 模型敲除检测、常见问题排查及 Cre 表达特性把控等关键内容,为科研人员提供标准化参考。
一、Flox 模型基因鉴定核心方案
(一)鉴定原理
Flox 等位基因(fl)相较于野生型(wt),除含 Loxp 位点外,还插入 80-100bp 外源序列(如酶切位点、公用引物序列)。通过设计特异性引物,借助 PCR 扩增可区分不同基因型。
(二)引物设计策略
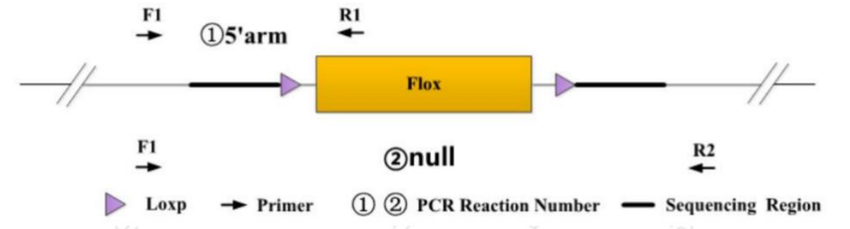
采用 “两端鉴定” 方案,在 Flox 区域的 5' 臂和 3' 臂分别设计引物(如 5' 臂的 F1、R1 引物),引物靶向插入序列两侧的同源序列,确保鉴定特异性。
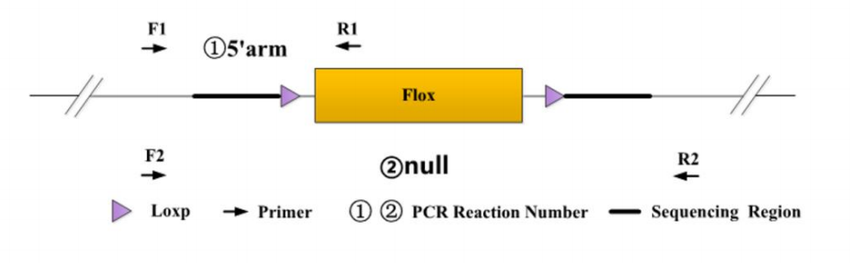
(三)基因型判断标准
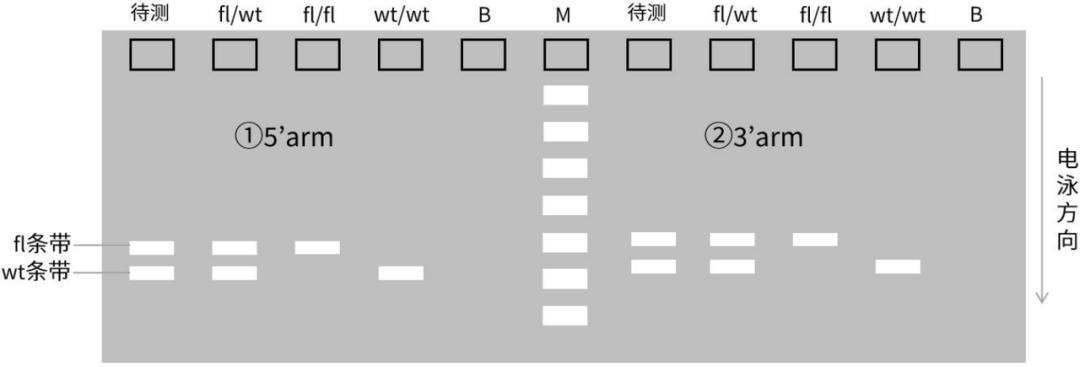
· wt/wt 基因型:仅扩增出 wt 条带;
· fl/fl 基因型:仅扩增出 fl 条带(比 wt 条带大 80-100bp);
· fl/wt 杂合子:同时出现 wt 条带与 fl 条带。
flox小鼠各基因型对应的凝胶电泳结果示意图
(B: Blank control; M: Marker)
二、CKO 模型基因敲除检测方法
(一)检测原理
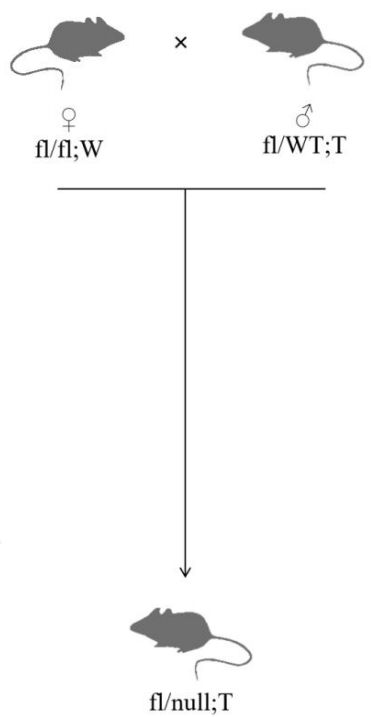
获得 Flox 纯合且 Cre 阳性小鼠(fl/fl;T)后,需验证目的基因在特定组织中的敲除效果。采用 “null 引物”(如 F1/R2)设计在 Flox 区域两端,若发生敲除,将扩增出变短的 null 条带,提示 Flox 区域已被切除。
(二)关键注意事项
Cre-Loxp 系统的敲除效率并非 100%,同一组织中可能同时存在已敲除和未敲除细胞,PCR 结果若出现 fl/null 条带共存,属于正常现象。
三、基因组 DNA 提取方法选择
高质量基因组 DNA 是 PCR 鉴定准确的前提,推荐三种常用方法,可根据样本类型、通量及下游应用选择:
1. 酚 - 氯仿法:传统有机溶剂提取法,适用于多种组织类型,DNA 纯度高,但操作步骤繁琐;
2. 商业试剂盒法(如 Qiagen DNeasy Blood & Tissue Kit):基于柱式纯化技术,操作简便快速,适合高通量样本处理,能减少污染;
3. 盐析法:通过高盐浓度沉淀 DNA,成本低、速度快,适用于鼠尾等小组织样本,纯度略低于前两种方法。
注:鼠尾组织提取 DNA 时,优先选择商业试剂盒法或盐析法,可获得更稳定的结果。
四、常见问题解析与应对
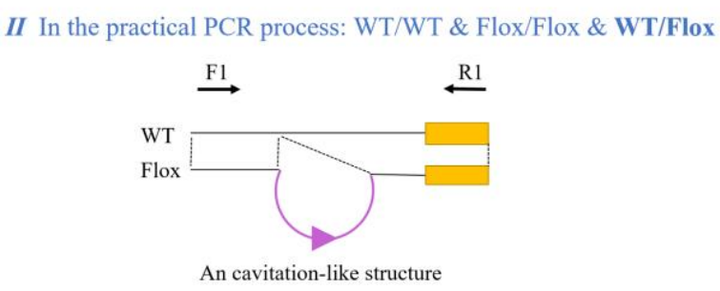
(一)fl/wt 样本出现三条带
· 可能原因:非特异性扩增,或 PCR 过程中 fl 与 wt 基因形成空泡状结构导致电泳速度减慢;
· 应对方案:优化 PCR 程序(如调整退火温度),减少非特异性结合。
(二)CKO 模型条带大小与预期不符
· 核心原因:Flox 与 wt 条带的大小差异源于 80-100bp 的外源插入序列,而非 34bp;
· 应对方案:使用高分辨率 DNA Marker,同时设置 wt 对照,确保条带判断准确。
(三)是否可仅用一端引物鉴定?
不建议。商业机构提供的基因编辑模型通常经过两端鉴定,以排除染色体交叉互换等低概率事件;后代鉴定中保持两端鉴定方案,能提升结果严谨性。
五、Cre 生殖系统泄露表达的影响与应对
(一)核心影响
部分启动子驱动的 Cre 可能在生殖系统泄露表达,导致非预期全身性敲除,影响繁育结果(如无法获得 fl/fl;T 小鼠)。例如 Prrx1 启动子驱动的 Cre,在肢芽表达的同时,生殖细胞中也存在活性。
(二)Cre 组织表达信息确认方法
1. 查询品系参考文献或 MGI 数据库;
2. 将 Cre 品系与荧光报告基因工具鼠配繁,通过报告基因表达情况判断 Cre 活性。
(三)泄露表达判断方式
使用 F2/R2 引物(设计在 Flox 区域上下游)检测鼠尾 DNA,可判断是否存在生殖系统泄露导致的子代全身敲除。
(四)泄露机制
以精子为例,Cre 在精子中表达会介导 Flox 区域剪接为 null 基因,该 null 基因通过遗传导致子代全身表达。
六、实验核心总结
1. Flox 模型鉴定需采用两端引物方案,关注条带大小差异,必要时优化 PCR 程序;
2. CKO 模型敲除效率非 100%,部分组织可能出现混合条带,属正常现象;
3. 严格把控 Cre 表达特性,通过查询数据库或配繁报告鼠确认组织特异性,避免生殖系统泄露导致实验偏差。
为助力科研人员深入掌握相关技术,药康生物整理了《Flox 模型鉴定方案解读与常见问题》和《Cre-Loxp 系统之 Cre 的生殖系统泄露表达》完整技术文档,可扫描下方二维码获取,为实验精准推进提供支撑。