in vivo CAR-T 技术赋能下一代细胞疗法研发
嵌合抗原受体 T 细胞(CAR-T)疗法在血液系统恶性肿瘤治疗中已取得突破性进展,但传统 Ex vivo CAR-T 疗法存在制备流程复杂、成本高昂、可及性低等局限,限制了其临床普及。新一代 in vivo CAR-T 技术通过靶向递送系统实现 T 细胞原位基因编辑与功能重塑,革新了 CAR-T 生产模式,为实体瘤及自身免疫性疾病等领域的应用拓展了新可能。药康生物依托高质量免疫系统人源化小鼠模型及标准化临床前药效评价体系,为 in vivo CAR-T 疗法研发提供全流程支持。
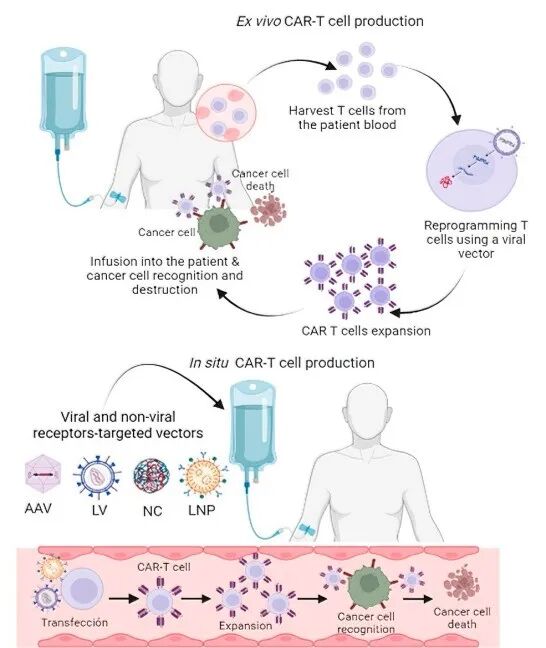
图1. 传统CAR-T(Ex vivo CAR-T)与in vivo CAR-T(In situ CAR-T)生产模式对比[1]
一、in vivo CAR-T 技术原理与核心优势
(一)技术原理
in vivo CAR-T 利用 T 细胞趋向性慢病毒、CD8⁺T 细胞靶向 LNP 等递送系统,将 CAR 编码元件(DNA/mRNA)精准递送至内源性 T 细胞。通过载体介导的基因转导或胞内释放,完成 CAR 的转录、翻译与膜表面表达,实现 T 细胞功能改造。改造后的 CAR-T 细胞可特异性识别肿瘤或病变细胞抗原,激活杀伤功能,实现靶向清除。
(二)核心优势
1. 流程简化:省去 “体外采集 - 基因改造 - 扩增 - 回输” 步骤,单次注射即可启动治疗,大幅缩短疗程;
2. 适用人群拓宽:降低对自体 T 细胞质量的依赖,覆盖更多患者群体;
3. 安全性提升:避免清淋预处理可能引发的感染等风险;
4. 应用场景拓展:为 CAR-T 在实体瘤、自身免疫性疾病等领域的应用提供可能。
二、药康生物人源化小鼠模型与药效评价数据
药康生物通过两类核心人源化小鼠模型,完成 in vivo CAR-T 疗法的临床前药效验证,数据如下:
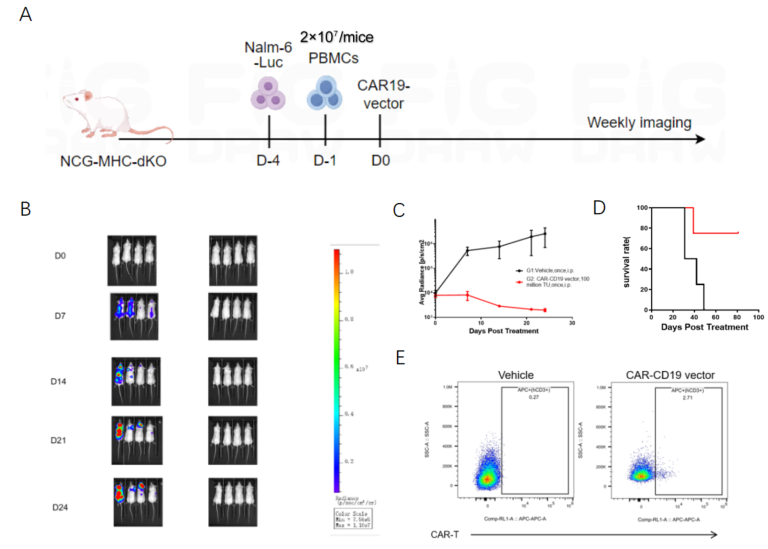
(一)huPBMC-NCG-MHC-dKO 小鼠药效评价
1. 实验流程:尾静脉接种 Nalm6-Luc 肿瘤细胞,腹腔注射 2×10⁷ PBMC 后,给予抗 CD19-CAR 慢病毒载体;通过流式检测 CAR 表达,活体成像监测肿瘤负荷;
2. 核心结果:治疗组对 Nalm6-Luc 肿瘤呈现显著生长抑制,生存期延长;对照组无抑瘤效果;治疗组可检测到人 T 细胞的 CAR 表达,证实体内编辑成功。
图2. in vivo CAR-T在huPBMC-NCG-MHC-dKO小鼠中的药效评价(合作验证数据)
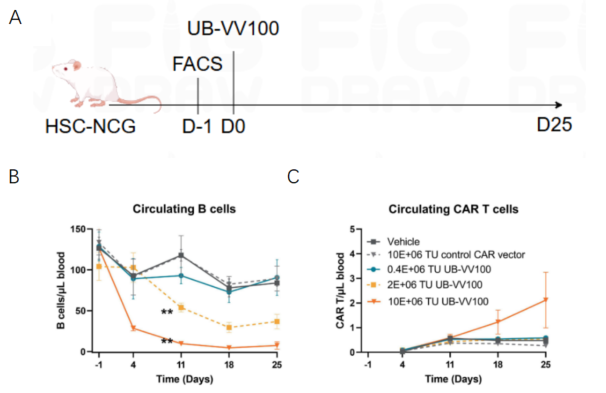
(二)huHSC-NCG 小鼠药效评价(以 UB-VV100 载体为例)
1. 实验流程:腹腔注射不同剂量 UB-VV100(编码 CD19-CAR 的临床候选药物),检测循环 B 细胞清除情况及 CAR-T 细胞比例;
2. 核心结果:B 细胞呈剂量依赖性清除,CAR-T 细胞比例随载体剂量升高而增加;该模型可有效评估 CAR-T 药物的靶向清除功能和体内动力学行为,结合 CDX/PDX 模型可拓展至非 B 细胞靶点评价。
图3. in vivo CAR-T在huHSC-NCG小鼠中的药效评价[2]
三、药康生物平台核心优势
1. 模型构建与供应能力:具备成熟的 huHSC-NCG 模型构建技术,可定期构建并高质量稳定供应,保障药效与安全性评价及时开展;
2. PBMC 资源与重建体系:拥有丰富的 PBMC 供体资源库及标准化重建流程,可快速匹配最适评价模型,确保实验高效启动与数据可靠;
3. 项目服务经验:拥有资深体内试验专家团队,累计服务 300+ IND 项目,可为药物研发提供专业支持,加速临床转化进程。
四、FAQ
Q:什么是in vivo CAR-T?它和传统CAR-T有什么区别?
A:传统CAR-T疗法(Ex vivo CAR-T)需要从患者体内采集T细胞,在体外进行基因改造、扩增,再回输给患者。这是一个复杂、定制化的体外生产过程。
in vivo CAR-T 则完全不同。它通过一次注射,将携带CAR基因的靶向递送系统(如病毒载体、纳米颗粒)直接注入患者体内。这些递送系统靶向T细胞,并完成原位基因改造,使其直接在患者体内变为CAR-T细胞。
Q:in vivo CAR-T是如何在体内工作的?
A:其工作流程基于精准的递送系统:
靶向递送:利用具有T细胞趋向性的慢病毒载体、或能靶向CD8⁺T细胞的脂质纳米颗粒(LNP)等系统,将CAR编码元件(DNA或mRNA)递送到体内的T细胞中。
原位改造:递送系统通过转导或释放,将CAR基因导入T细胞内部。T细胞随后利用自身的“机器”完成CAR基因的转录、翻译,最终在细胞膜表面表达出CAR蛋白。
识别与杀伤:这些在体内新生成的CAR-T细胞能够特异性识别肿瘤抗原,从而被激活、增殖,并清除肿瘤细胞。
Q:相比传统CAR-T,in vivo方法有哪些显著优势?
A:流程极大简化:省去了体外细胞采集、培养、扩增和回输的全套复杂流程,实现“单次注射即可启动治疗”,大幅缩短疗程。
降低个体依赖:降低了对患者自体T细胞起始质量和数量的依赖,有望拓宽适用人群。
避免清淋风险:避免了传统疗法中为“腾出空间”而进行的淋巴细胞清除性化疗,从而规避了由此可能引发的感染等风险。
治疗模式变革:正在推动细胞治疗从“复杂定制化工程”向“便捷通用型药品”的跨越。
五、结语
in vivo CAR-T 技术正推动细胞治疗从 “复杂定制化工程” 向 “便捷通用型药品” 跨越,其临床转化高度依赖精准的临床前研究模型。药康生物不仅提供 huPBMC-NCG-MHC-dKO、huHSC-NCG 等核心人源化小鼠模型,还搭建了适配该疗法的一站式临床前药效评价体系,可系统评估疗效、体内基因编辑效率及 CAR 表达情况。
药康生物致力于为科研人员提供从模型供应到数据产出的全流程支持,助力 in vivo CAR-T 疗法的研发与转化进程,加速下一代细胞疗法的临床落地。
参考文献
[1] Int J Mol Sci. 2023 Oct 28;24(21):15688.
[2] J Immunother Cancer. 2023 Mar;11(3):e006292.