集萃药康LAG-3人源化模型家族祝贺BMS的LAG-3抗体三期临床成功
2021年3月25日,百时美施贵宝(BMS)公布LAG-3单抗药物RELATIVITY-047 III期临床研究初步结果,相比于单独使用PD-1抗体治疗转移性或不可手术切除的黑色素瘤,PD-1抗体Opdivo联合LAG-3抗体Relatlimab可显著改善患者无进展生存期(PFS)。临床研究随访仍在进行中,目前联合疗法耐受性良好,未出现任何预期外的安全性事件。

LAG-3(Lymphocyte-activationgene 3),又名CD223,由Frédéric Triebel及其团队于1990年首先发现。LAG-3也是一类免疫检查点受体蛋白,主要表达于活化的CD4+T、CD8+T、B细胞、NK细胞以及树突状细胞等免疫细胞表面。LAG-3与CD4受体的蛋白序列相似,但亲和力强于CD4。LAG-3其配体之一是主要组织相容性复合体MHCII类分子,主要位于APC类细胞,其另一配体为DC-SIGN族成员之一LSECtin,主要表达在肝细胞和肿瘤细胞表面(如图1所示)[1]。

图1. LAG-3及其配体分布示意图[1]
LAG-3对各种类型的淋巴细胞产生不同的抑制作用(如图2所示)[2]。其中LAG-3主要抑制T细胞的活化和细胞因子分泌,从而保持机体免疫稳态。敲除LAG-3基因或体内抗体阻断LAG-3功能,可提升IL2、IL-4、IFN-γ和TNFα等细胞因子的分泌,使器官或肿瘤中的抗原特异的CD8+T细胞的聚集和效应功能增加[3]。因此,阻断LAG-3是一种潜在的肿瘤治疗方法。

图2. LAG-3与TILs细胞的关联性[2]
在癌症疾病中,LAG-3与PD-1、CTLA-4等免疫检查点具有显著的协同抑制免疫作用(如图3所示)[4,5],如,PD-1和LAG-3协同会加速T细胞耗竭。联合使用PD-1抗体和LAG-3抗体有望进一步解除机体免疫抑制,实现良好的抗肿瘤效果。

图3. LAG-3信号传导以及与其他免疫检查点相互作用示意图[2]
目前全球范围内,多家药企布局了LAG-3靶点融合蛋白或抗体,国内再鼎医药、药明康德、岸迈生物、时迈药业、恒瑞医药,维立志博、信达生物、复宏汉霖、科伦博泰等生物医药公司的LAG-3抗体已经申报临床(如图4所示)。
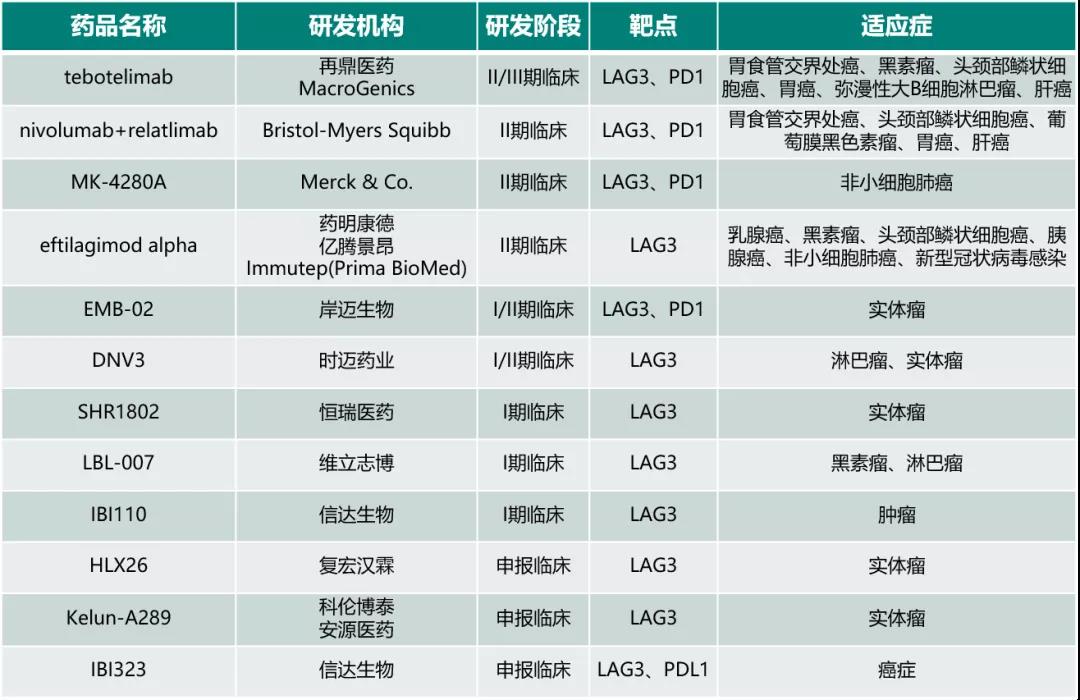
图4. 国内LAG-3靶点药物研发状态(数据来源于医药魔方数据库)
LAG-3肿瘤免疫抗体药物是国内外医药企业药物研发投入的重点领域。可靠的动物模型,尤其是人源化小鼠模型,可以加快肿瘤免疫抗体药物的研发进程。
集萃药康利用基因编辑技术将小鼠的Pdcd1、Pdl1和Lag3基因编码胞外区的部分替换为相应的人源PD1、PDL1和LAG3基因片段,同时保留了鼠源相应基因的胞内信号转导区,保证了细胞信号的正确传导不受影响。B6小鼠和BALB/c小鼠背景的Pdcd1、Pdl1和Lag3单靶点、双靶点以及三靶点的人源化小鼠模型,该类模型是筛选和评价人PD1、PDL1与LAG3抑制剂药物以及联合用药的理想动物模型。
基于BALB/c-hPD1/hLAG3的体内药效试验。利用BALB/c-hPD1/hLAG3小鼠皮下接种CT26.WT模型评价Anti-LAG3与Keytruda的体内药效实验。
结果显示:单药组Anti-LAG3(5mpk),Anti-LAG3(10 mpk)对肿瘤生长具有抑制作用,且高剂量的Anti-LAG3肿瘤抑制效果更为显著;单药组Keytruda(1mpk),Keytruda(3mpk)对肿瘤的生长有明显抑制作用,抑制效果相近。
结果表明:PD1、LAG3双人源化小鼠是评估anti-hPD1和anti-hLAG3抗体体内联合药效的理想动物模型。

除了LAG-3靶点的人源化模型,集萃药康还有众多免疫检查点欢迎垂询。

参考文献
[1] Ana Cet al. Kuchroo, Lag-3, Tim-3, and TIGIT: Co-inhibitory Receptors withSpecialized Functions in Immune Regulation. Immunity; 44, 5, 2016, 989-1004.DOI:10.1016/j.immuni.2016.05.001.
[2] Long L, et al. The promising immune checkpoint LAG-3: from tumor microenvironment to cancer immunotherapy. Genes Cancer. 2018; 9(5-6): 176-189. DOI: 10.18632/genesandcancer.180.
[3] Grosso, et al. LAG-3 regulates CD8+ T cell accumulation and effector function in murine self-and tumor-tolerance systems." The Journal of clinical investigation; 2007, 117, 11, 3383-3392.
[4] Burugu S et al. Nielsen, LAG-3+ tumor infiltrating lymphocytes in breast cancer: clinical correlates and association with PD-1/PD-L1+ tumors. Annals of oncology, 2017, 28,12;2977-2984. DOI:0.1093/annonc/mdx557
[5] Huang UY, et al. Compensatory upregulation of PD-1, LAG-3, and CTLA-4 limits the efficacy of single-agent checkpoint blockade in metastatic ovarian cancer. OncoImmunology, 2017, 6, 1. DOI:10.1080/2162402X.2016.1249561

