Nature Communications丨山东大学团队运用动脉粥样硬化模型发现疾病“帮凶”RNF128
近日,山东大学齐鲁医院张澄教授、张猛教授和高成江教授团队合作在《Nature Communications》发表题为“E3 ubiquitin ligase RNF128 promotes Lys63-linked polyubiquitination on SRB1 in macrophages and aggravatesatherosclerosis”的研究成果,该研究通过运用动脉粥样硬化模型系统揭示了E3泛素连接酶RNF128在动脉粥样硬化发病过程中的致病作用,明确其介导通过Lys63型泛素链修饰调控巨噬细胞SRB1表达功能,为靶向干预泡沫细胞形成提供了潜在策略。
什么是动脉粥样硬化?
动脉粥样硬化(Atherosclerosis, AS)是一种由动脉壁慢性炎症和脂质沉积引起的疾病,主要特征是血管狭窄和血流受阻。尽管动脉粥样硬化性心血管疾病(ASCVD)的治疗和管理近年来取得显著进展,但其仍是全球主要的死亡原因之一。巨噬细胞在AS斑块形成中至关重要,其通过清道夫受体(如SRA1、SRB1和CD36)摄取低密度脂蛋白(LDL)或氧化LDL(oxLDL),形成泡沫细胞。而ABCA1和ABCG1则负责将胆固醇从巨噬细胞中排出。若脂质摄取过多或排出不足,即会导致泡沫细胞积累,从而加重病情。
动脉粥样硬化如何发挥作用?
该研究采用了集萃药康RNF128fl/fl、Lyz2cre 以及 ApoE-/-小鼠。巨噬细胞特异性RNF128条件敲除 (RNF128-CKO) 小鼠通过将 RNF128fl/fl小鼠与 Lyz2cre小鼠杂交获得,命名为 RNF128fl/flLyz2cre小鼠。为构建动脉粥样硬化模型,将RNF128fl/flLyz2cre小鼠进一步与ApoE-/-鼠杂交,生成ApoE-/-RNF128fl/fl Lyz2cre小鼠。
RNF128高表达于AS斑块巨噬细胞
研究通过单细胞转录组分析发现,RNF128主要表达于高脂饮食诱导的动脉粥样硬化小鼠斑块中的Lyz2+巨噬细胞群。免疫荧光染色和Western blot进一步表明,RNF128在小鼠及人动脉粥样硬化晚期病变中显著上调,且表达高度依赖于oxLDL负荷,而非单纯炎症刺激。
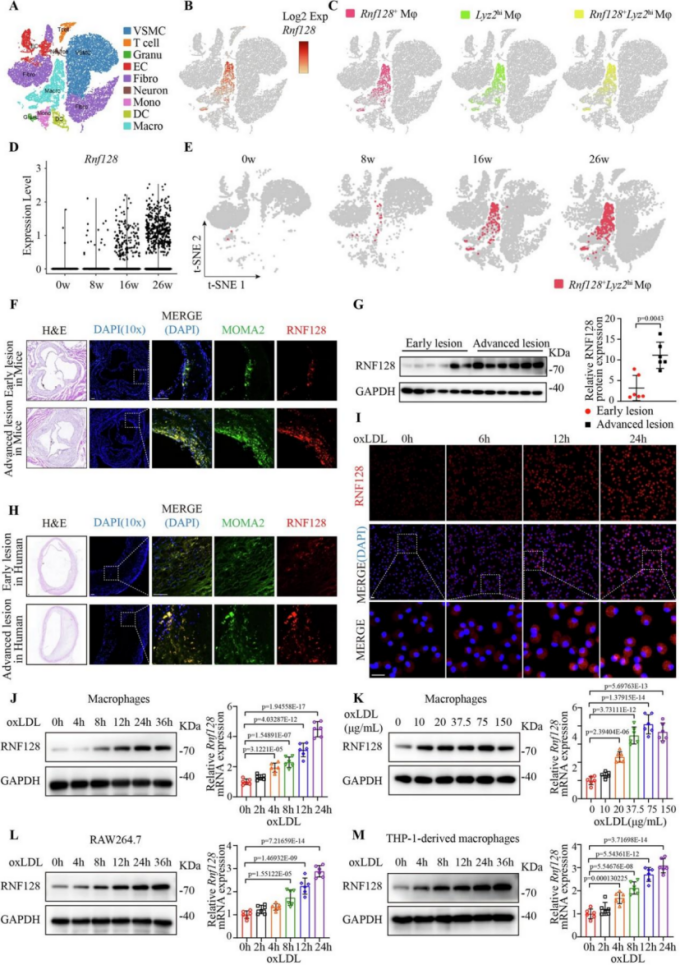
图1. RNF128在小鼠及人类动脉粥样硬化病变巨噬细胞中上调
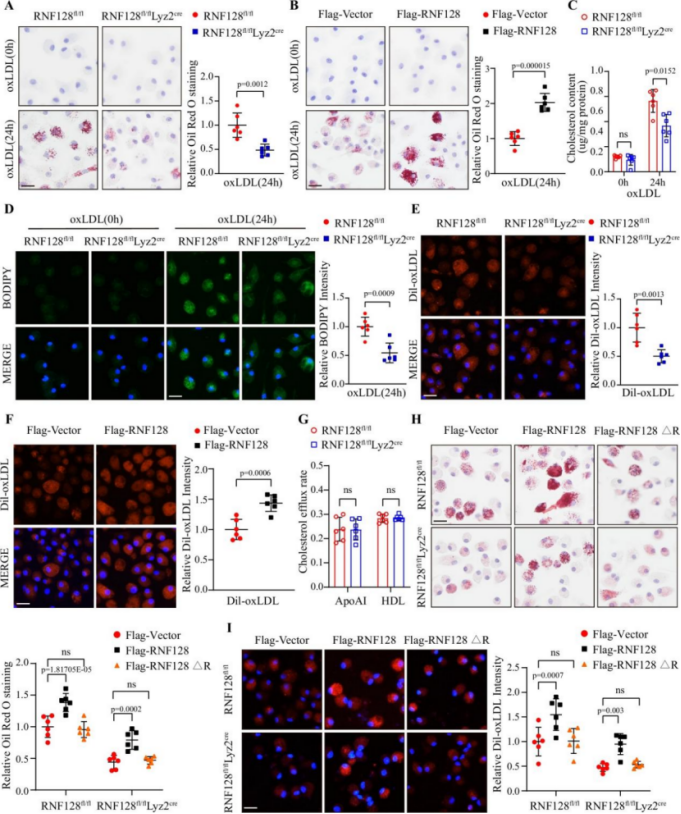
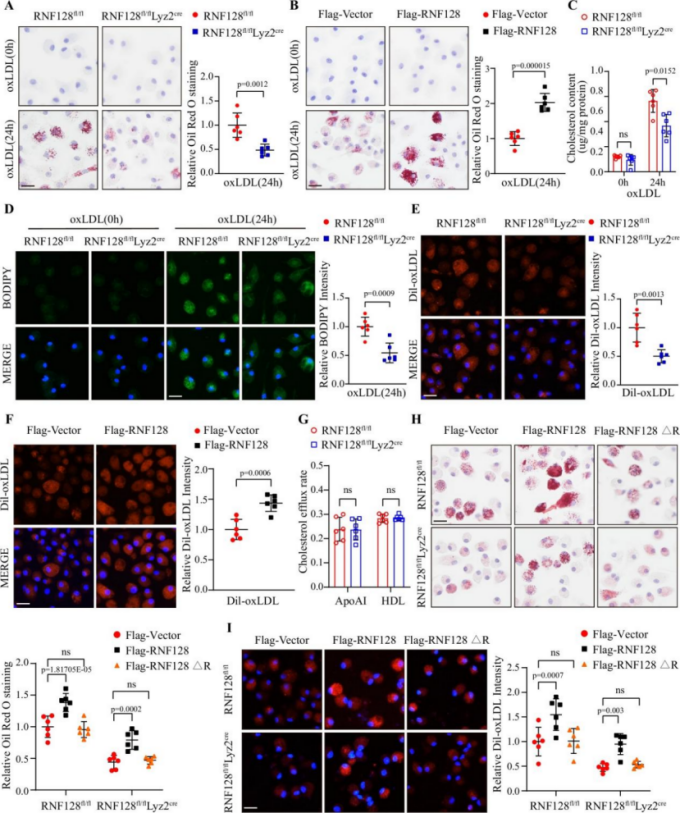
巨噬细胞RNF128特异性敲除可减轻动脉粥样硬化进展
研究显示,构建RNF128条件性敲除小鼠模型(RNF128fl/fl;Lyz2Cre)后,在ApoE−/−与PCSK9介导的LDLR−/−背景中均显示动脉粥样硬化病变面积显著缩小。体外实验进一步证实,RNF128敲除可减少oxLDL摄取、总胆固醇积累与脂滴形成。而RNF128过表达则增强泡沫细胞形成,且该效应依赖其RING结构域的E3连接酶活性。
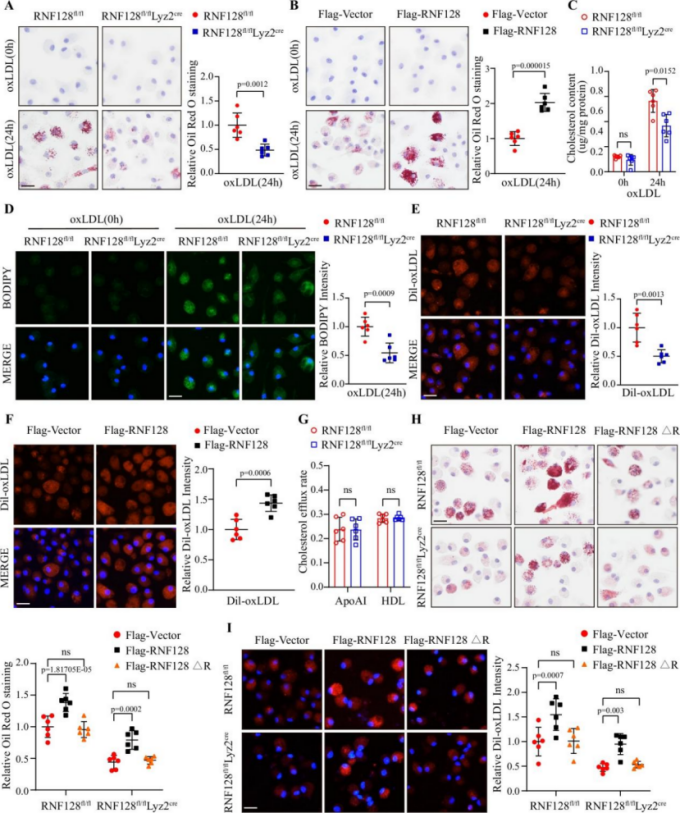
图2. RNF128调控巨噬细胞脂质积累与泡沫细胞形成
RNF128 泛素化修饰 SRB1 抑制其降解并促进 oxLDL摄取
机制研究发现,RNF128以Lys63连接的多聚泛素链修饰巨噬细胞表面清道夫受体SRB1,修饰位点定位于其C端胞质区的K478残基。该修饰可避免SRB1进入溶酶体降解通路,转而通过Rab11依赖性途径回收至细胞膜,从而增强oxLDL摄取,促进泡沫细胞形成与炎症反应。
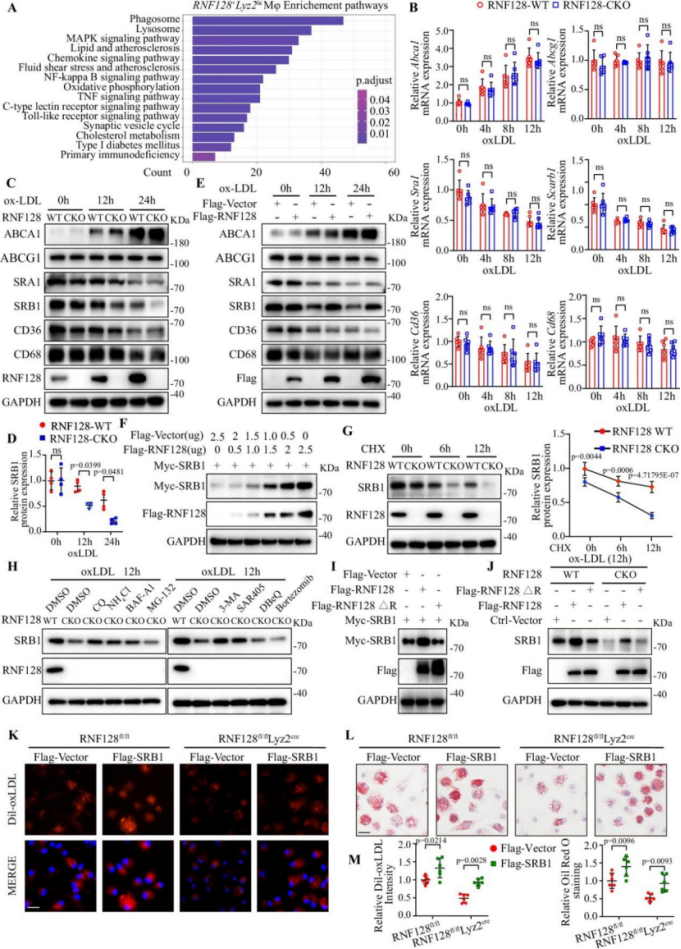
图3. RNF128促进SRB1膜定位并通过K63泛素化避免其降解
临床前意义与潜在转化价值
本研究借助动脉粥样硬化模型阐明了RNF128在动脉粥样硬化中的关键致病作用,揭示其通过泛素化调控SRB1的新机制。靶向RNF128—SRB1轴可从源头阻断泡沫细胞生成,有望成为抗动脉粥样硬化的潜在干预靶点。
参考文献
Nature Communications volume 16, Article number: 2185 (2025)
图3. RNF128促进SRB1膜定位并通过K63泛素化避免其降解
临床前意义与潜在转化价值
本研究借助动脉粥样硬化模型阐明了RNF128在动脉粥样硬化中的关键致病作用,揭示其通过泛素化调控SRB1的新机制。靶向RNF128—SRB1轴可从源头阻断泡沫细胞生成,有望成为抗动脉粥样硬化的潜在干预靶点。