转基因小鼠模型的构建(转基因小鼠的制备流程图)
这里说的转基因,并非广义上的所有的基因修饰,而是特指外源基因随机地整合到小鼠染色体上获得的随机插入转基因小鼠。
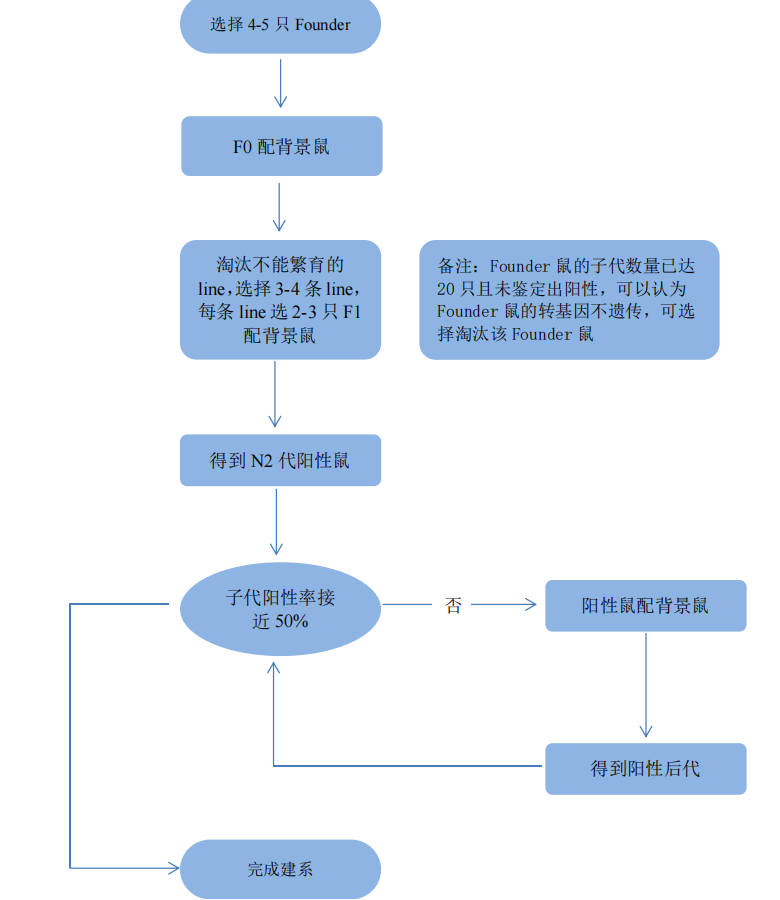
转基因小鼠的制备流程图:
转基因模型需选择多只首建鼠用于繁育建系,以提高转基因小鼠建系筛选成功的概率。每只首建鼠分别与背景鼠交配建系,首建鼠与首建鼠不能相互交配。
转基因小鼠模型的构建常用技术:
转基因小鼠的制备技术主要有两类,DNA原核显微注射法和胚胎干细胞囊胚显微注射法。
1、DNA原核显微注射法
通过显微操作仪将外源基因直接注入受精卵,使外源基因整合到DNA中,发育成转基因动物。此方法是最经典的用于制作转基因动物的方法,也是目前应用最广泛的方法,现在的转基因动物研究大都是在Palmiter等方法的基础上有所改进而进行的。由这种方法制备的动物品种属于狭义的转基因动物的范畴。
由这种方法制备的转基因小鼠其插入目的基因的形式通常是多拷贝首尾相连的形式,其整合到基因组的具体机制目前并没有完全研究清楚。
2、胚胎干细胞囊胚显微注射法
是在体外将外源基因导入胚胎干细胞;然后将转基因的胚胎干细胞通过显微操作仪注入动物囊胚,此胚胎干细胞可参与宿主的胚胎构成,形成嵌合体,直至达到种系嵌合。胚胎干细胞体外培养时保持未分化状态,当被注入囊胚腔后,可以参与包括生殖腺在内的各种组织嵌合体的形成,因此将外源DNA导入胚胎干细胞就可实现基因的转移。出生的动物其生殖系统就可能整合上外源基因,通过杂交繁育可得到具有纯合目的基因的个体,即转基因动物。目前,胚胎干细胞介导法在小鼠上应用比较成熟,在大动物上应用较晚。基因的敲除及捕获常用这类方法。
转基因小鼠的优缺点及注意事项?
对于普通的转基因,表达的区域将取决于启动子。如果选择全身表达的启动子,如CAG、EF1α、CMV等将得到全身表达的转基因小鼠;如果选择一些组织特异性表达的基因的启动子,将得到组织特异性表达的转基因小鼠,如在AP2的promoter启动下进行表达,会得到脂肪组织特异表达的转基因小鼠。
需要特别说明的是,转基因的策略是将转基因片段直接注射到小鼠的受精卵中,转基因片段将会在小鼠基因组中进行随机插入,因为是完全随机的,有可能会插入到一些抑制区导致转入的基因不表达,也有可能插入到一些增强区导致转入的基因高表达,通常会出现在小鼠基因组中多拷贝插入的现象。
通过原核注射的方法得到的第 一代转基因小鼠称为 founder(首建鼠),由于上述随机性,每一只founder都是不一样的,以每一只founder起源构建得到的可稳定遗传的品系称为line,不同的line之间的表达由于实际插入位点的不同和/或插入拷贝数的不同会有差异。首建鼠与首建鼠之间不应该相互交配。
转基因小鼠的饲养
1、用于建系和种系保存的转基因小鼠一般饲养于SPF级环境中。
2、饲养室内的温度保持在22-28℃,相对湿度维持在40%-60%,饲养盒内温度一般比外界环境高1~2℃,湿度高5~10%。昼夜明暗交替时间为12/12;噪音<60dB, ;氨浓度不超过20ppm,换气次数应达到10~20次/小时;饲养室内每天经紫外灯照射两小时杀菌,定期用消毒水进行清洁消毒。
3、饲料:采用60Coγ射线灭菌的无菌全价营养颗粒料,并可定时喂少量葵花籽。成年转基因鼠采食量一般为3~7克/天,转基因幼鼠一般为1~3克/天,应每周添料3~4次,在鼠笼的料斗内应经常有足够量的新鲜干燥饲料,在转基因小鼠大群饲养中,每周应固定两天添加饲料,其它时间可根据情况随时注意添加。
4、饮用水:为纯净水装瓶后高压灭菌,每周换水2~3次,成年鼠饮水量一般为4~7ml/天,要保证饮水的连续不断,应常检查瓶塞,防止瓶塞漏水造成动物溺死或饮水管堵塞使小鼠脱水死亡。
5、垫料:使用经高压灭菌的混合木屑或者玉米芯;鼠笼采用M5型小鼠饲养笼,高压灭菌。鼠笼和垫料每周更换两次。各种操作均在超净工作台内按照无菌操作进行。
6、日常登记和观察:每天登记各环境数据和小鼠状况,密切观察小鼠饮食、活动及全身情况,若有发现异常状况时需登记检查原因。外观判断小鼠健康的标准是:
①食欲旺盛;
②眼睛有神,反应敏捷;
③体毛光滑,肌肉丰满,活动有力;
④身无伤痕,尾不弯曲,天然孔腔无分泌物,无畸形;
⑤粪便黑色呈麦粒状
即将产崽或刚产崽的的转基因鼠尽量不去打扰,以免刺激到母鼠,可提前加足水和饲料;产崽前可在笼盒内添加一定量的棉絮供其筑窝用。
对于即将运用于实验的转基因小鼠,如无特殊体质缺陷(如营养缺陷型,免疫缺陷型等),可适用普通小鼠的饲养标准。

