科研避坑指南:你的小鼠模型可能被遗传背景“带跑偏”了!
在生物医学研究中,小鼠模型是研究人类疾病的关键工具。越来越多的研究表明,小鼠的遗传背景对实验结果有着深远影响。这种差异不仅影响小鼠的表型,还可能改变实验结果的可靠性和可重复性。今天,集萃药康就从同一背景不同亚系及基因编辑小鼠为例,探讨遗传背景对小鼠代谢功能的影响。
什么是小鼠模型的“遗传背景”?
遗传背景(genetic background)在遗传学中指目标基因或突变位点之外的全基因组遗传组成,包括其他基因的基因型、非编码调控序列及染色质结构等。这些因素可通过基因互作(epistasis)或表观遗传修饰等机制影响特定表型的表达。
实验小鼠遗传背景研究的奠基人是克拉伦斯·库克·利特尔(Clarence Cook Little)。1907年,他在哈佛大学威廉·卡斯尔(William Castle)实验室开始了小鼠遗传学研究,认识到当时小鼠群体的遗传异质性会导致实验结果变异。为控制这一变量,他提出通过近交繁殖建立遗传均一的品系。历经六年努力(1909-1915),利特尔团队逐步培育出首个近交系小鼠品系—DBA。这一突破标志着实验动物遗传标准化研究的开端。
后续研究证实,不同遗传背景的小鼠模型在神经、代谢及免疫功能上存在显著差异。值得注意的是,即便是同一近交品系,因长期分育也可能因遗传漂变产生亚系分化。典型的例子如C57BL/6J与C57BL/6N。
C57BL/6J与C57BL/6N代谢表型差异

C57BL/6J (B6J):1947年由美国杰克森实验室(Jackson Laboratory)引进C57BL/6进行培育并命名。
C57BL/6N (B6N):1951年,美国国立卫生研究院(NIH)从杰克森实验室引入了C57BL/6J第32代,并由此形成亚系。
尽管遗传背景高度相似,两种亚系仍存在多个单核苷酸多态性位点,这些差异影响了代谢相关基因的表达和功能。
早期研究发现,B6J小鼠存在烟酰胺核苷酸转氢酶(Nnt)基因的外显子缺失,导致其在给予高脂饮食(HFD)后表现出更高的血糖水平、胰岛素分泌受损、更严重的肝脏脂肪变性和氧化应激损伤。相比之下,B6N小鼠的Nnt基因完整,表现出更好的血糖耐受性和胰岛素敏感性[1]。
随着研究的深入,人们发现仅凭Nnt错义突变并不能完全解释两亚系的代谢表型差异。HFD和对照饮食(CD)下B6J与B6N小鼠的表型及RNA测序对比研究发现,包括Ide、Adss2、Entpd4、Wdfy1、Dynlt1在内的多个基因的表达水平存在差异,并伴随体重、脂肪重量、糖脂代谢及能量消耗等多方面变化[2],如B6N小鼠对高卡路里饮食刺激表现出更高的体重增加和脂肪积累敏感性(图1),其瘦素和胰岛素水平动态以及能量代谢水平也存在显著不同(图2)。
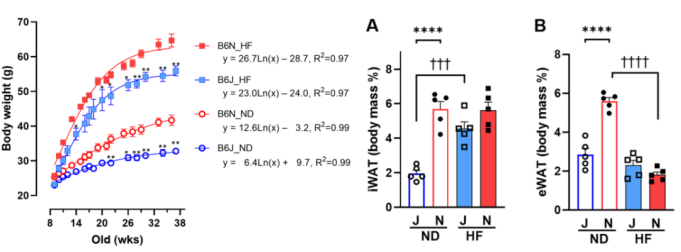
图1. HFD/CD饲养条件下,B6J/B6N小鼠的体重及脂肪量
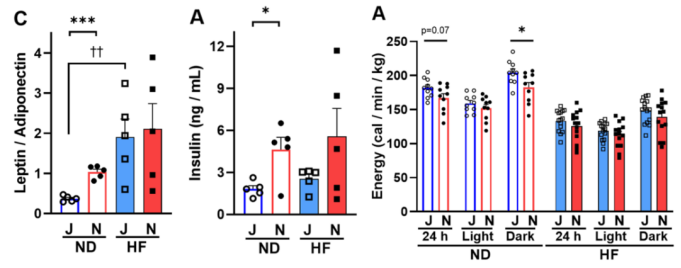
图2. HFD/CD饲养条件下,B6J/B6N小鼠的瘦素/胰岛素水平及能量代谢水平
基于小鼠模型不同遗传背景的基因编辑产生的代谢功能影响(BKS-db/B6-db)
随着基因工程小鼠技术的进步,研究者开始关注在不同遗传背景上进行相同基因编辑所产生的表型差异。这类研究不仅有助于深入理解基因功能差异(例如,不同遗传背景下EGFR基因的缺失,会导致不同程度的仔鼠死亡[3]),也催生了具有不同代谢表征的动物模型,如BKS-db/B6-db小鼠。
db小鼠的突变基因(db, Lepr基因的突变)最早于1966年在C57BL/KsJ近交系小鼠中被发现。该突变由单隐性基因引起,导致小鼠出现肥胖和糖尿病症状。对Lepr<db>基因在B6和BKS遗传背景中差异的研究始于上世纪70年代[4],Coleman等人发现:
在C57BL/6J(BL/6)的背景下,Lepr<db>的突变导致严重肥胖、轻度葡萄糖耐受不良、短暂性高血糖和严重高胰岛素血症。胰岛β细胞表现为代偿性增生肥大,无明显退化,使得后期血糖趋于恢复正常,小鼠寿命超过2年。
而C57BL/KsJ(BL/Ks)背景下,相同的突变导致严重糖尿病,伴有胰岛萎缩和β细胞退化。突变小鼠的胰岛β细胞在12-16周龄时停止增殖,随后发生退化和胰岛素分泌减少,最终诱发严重糖尿病,小鼠寿命缩短至5-8个月。此外,C57BL/KsJ(BL/Ks)背景下的糖尿病小鼠还表现出多种并发症,如周围神经病变、微血管病变、肾小球滤过功能障碍和免疫复合物沉积等(表1),为模拟临床糖尿病泛血管疾病并发症提供了良好的研究模型。
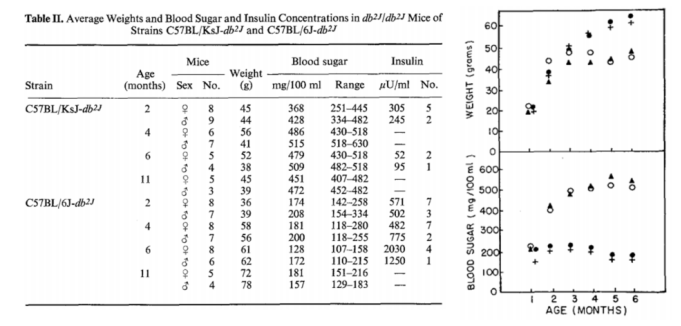
表1. C57BL/KsJ-db2J和C57BL/6J-db2J品系小鼠的平均体重以及血糖和胰岛素浓度
利用基因编辑技术和胚胎注射技术,集萃药康成功地在BKS背景上构建了Lepr基因突变小鼠模型(BKS-db,品系编号T002407)。该模型具有显著特征:5周龄体重显著上升,4~8 周龄是血糖快速升高期,8周龄后血糖趋于稳定发病水平的特征(图3,图4)。
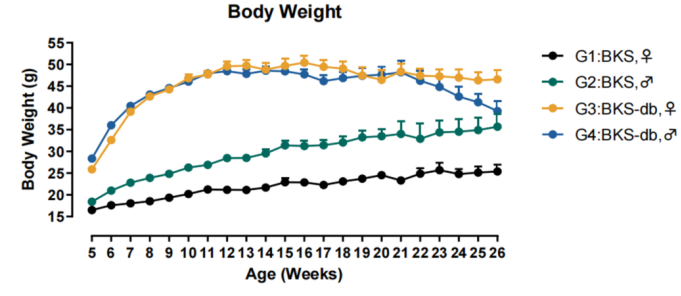
图3. BKS-db小鼠体重水平

图4. BKS-db小鼠血糖水平
遗传背景与基因编辑助力糖尿病肾病动物模型的临床转化
糖尿病肾病(DN)是全球人类终末期肾病的主要原因,影响20%-50%的糖尿病患者。然而,常见的DN小鼠模型常面临临床病理进展差异大,复杂因素难以模拟等问题[5]。在肾病研究中,尽管C57BL/6品系被普遍采用,但该背景小鼠对糖尿病肾病具有一定抗性,通常表现为轻度白蛋白尿和轻微的病理学变化[6]。
为更好地模拟人类DN的临床特征,集萃药康利用基因编辑技术,培育出BKS-Nos3基因敲除小鼠,并将其与BKS-db小鼠杂交,成功获得BKS-db;Nos3基因敲除小鼠(BKS-db-eNOS KO,品系编号T053852)。
内皮型一氧化氮合酶(eNOS)由Nos3基因编码,是催化一氧化氮(NO)生成的关键酶。eNOS在维持血管功能、保护血管内皮、调节血管生物学以及参与血管新生和损伤修复中发挥重要作用。Nos3基因敲除导致小鼠eNOS缺乏和全身性高血压。在Lepr突变的糖尿病小鼠中引入Nos3缺失(eNOS缺乏),能够协同加速糖尿病肾病的进展并加重其严重程度。肾脏病理染色(图5)显示BKS-db; Nos3-KO小鼠较BKS-db小鼠更早出现肾小球和肾小管间质损伤(PAS染色)及纤维化(Masson染色)。同时,尿白蛋白/肌酐比值(UACR)监测也证实了其肾脏功能受损的进行性加重(图6)。
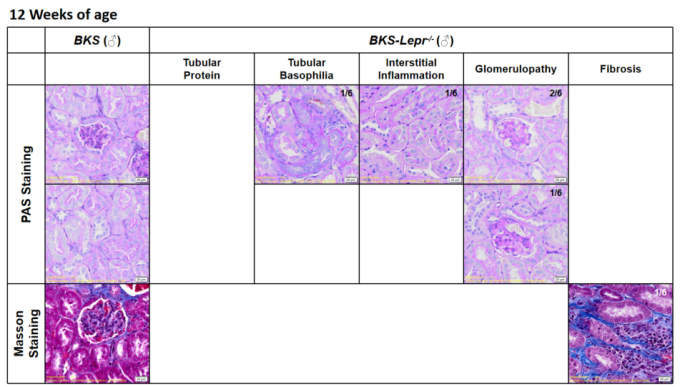
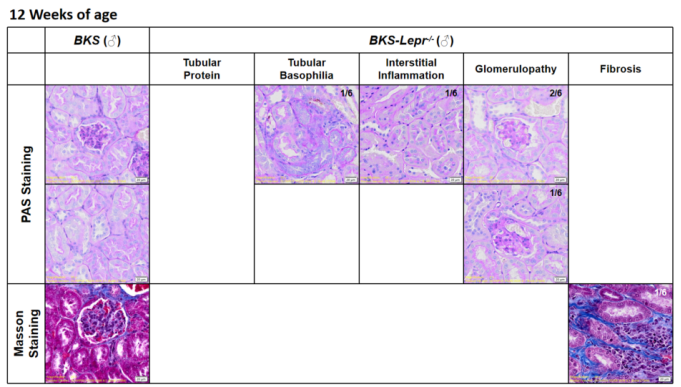
图5. 12周龄BKS-db小鼠及8周龄BKS-db;Nos3-KO小鼠肾脏PAS及Masson染色结果

图6. BKS、BKS-db、BKS-db;Nos3-KO小鼠UCAR水平
综上所述,遗传背景在小鼠模型中扮演着至关重要的角色。即使是同一品系的不同亚系,也可能因细微的遗传差异(如单核苷酸多态性)或基因表达水平的差异,导致显著的代谢功能表型差异。因此,在选择实验小鼠时,务必明确其精准的亚系背景,这对于确保实验结果的准确性、可重复性以及临床转化研究的可靠性至关重要。
参考文献
[1] Exp Anim. 2021 May 13;70(2):145-160.
[2] PLoS One. 2022 Dec 22;17(12):e0271651.
[3] Science. 1995 Jul 14;269(5221):230-4.
[4] Diabetes. 1981 Dec;30(12):1029-34.
[5] Nat Rev Nephrol. 2018 Jan;14(1):48-56.
[6] Kidney Int. 2022 Jul;102(1):38-44.

