解决GvHD难题,有集萃药康NCG-MHC-dKO小鼠模型就够啦!
人源PBMC (Peripheral Blood Mononuclear Cells) 异体移植后的移植物抗宿主病 (Graft-versus-Host Disease,GvHD) 是一种严重的并发症,也是引起移植后死亡的主要原因。因此,开发合适的小鼠模型来研究GvHD的发病机制、探索新的治疗策略以及评估抗体药物的疗效和安全性显得尤为重要。
集萃药康开发了NCG-MHC-dKO小鼠模型,该模型在缓解人源PBMC异体移植GvHD的同时,保持了IgG抗体的正常半衰期,并可以较好用于CD3 T细胞功能及抗体药物研究。本文将介绍该模型的特点、优势以及其在GvHD研究和免疫治疗领域的应用前景。
NCG-MHC-dKO 小鼠模型和GvHD药物评价
1. NCG-MHC-dKO 小鼠模型的特点
NCG-MHC-dKO小鼠模型是在NCG小鼠背景上同时敲除MHC I类(H2k1,H2d1)和MHC II(H2Ab1)类分子而构建的模型。该小鼠结合了严重的免疫缺陷突变(Scid)、Il2rγ基因敲除和 MHC I/II 分子缺乏的特点,最*大限度减缓移植物抗宿主病(GvHD)反应并延长实验的窗口期,并保证免疫细胞比例正常和抗体分子评价的准确性。
2. 小鼠模型对GvHD的缓解作用
NCG-MHC-dKO小鼠在人源PBMC异体移植后显示出较低的GvHD发生率和严重程度。这是由于异体免疫细胞对于NCG-MHC-dKO小鼠的免疫系统的攻击能力较弱,从而减轻了GvHD引起的组织损伤,并且显著延长了NCG-MHC-dKO小鼠的生存期。该模型为研究GvHD的发病机制、寻找新的治疗策略以及评估药物疗效提供了有力的工具。
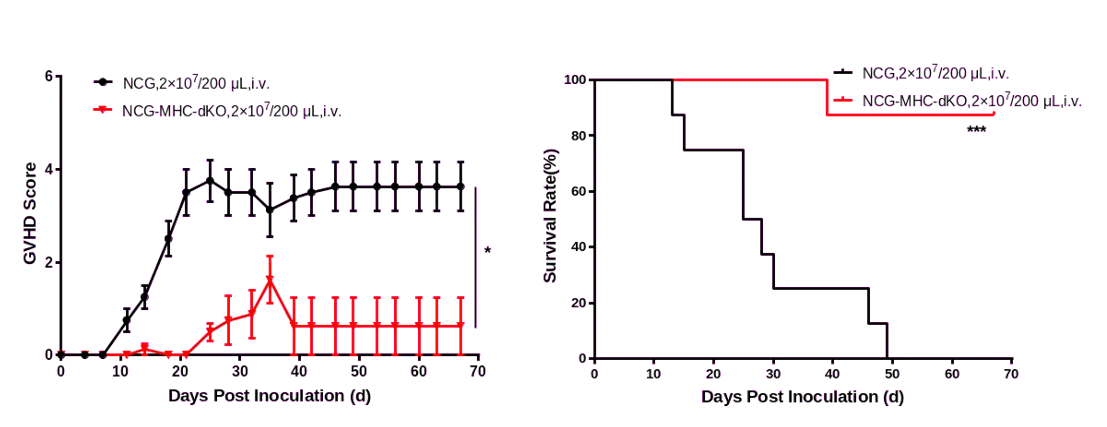
图1.NCG-MHC-dKO小鼠接种人源PBMC后的GvHD评分(左)和生存期(右)
NCG和NCG-MHC-dKO小鼠都移植2x107个人源PBMC细胞。结果发现与NCG小鼠相比,NCG-MHC-dKO小鼠表现出的GvHD症状更轻且具有更长的生存周期。
3. 对IgG半衰期的影响
值得注意的是,NCG-MHC-dKO小鼠模型保持了IgG抗体的正常半衰期。这一特点非常重要,因为IgG抗体在免疫治疗中起着重要的作用。保持正常的IgG抗体半衰期使得该模型能够更准确地评估抗体药物的疗效,为抗肿瘤免疫治疗的开发提供了可靠的平台。
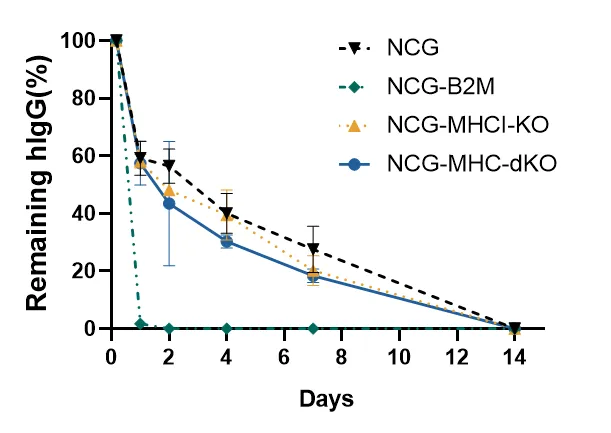
图2.NCG-MHC-dKO小鼠中人源IgG的半衰期
与NCG小鼠相比,NCG-B2M小鼠的人hIgG清除速度更快,而NCG-MHC-dKO小鼠的hIgG半衰期与NCG小鼠相似。
4. CD3 T细胞功能及抗体药物研究
通过移植人源PBMC,NCG-MHC-dKO小鼠模型为研究CD3 T细胞的激活、增殖和功能提供了独特的机会。研究人员可以利用该模型评估不同CD3 T细胞亚群的功能,进一步探索其在GvHD发展中的作用,并为新的免疫治疗策略的开发提供重要的信息。此外,NCG-MHC-dKO小鼠模型还可用于评估CD3 T细胞功能抗体药物的疗效和安全性,为抗肿瘤免疫治疗的研究和开发提供了有力的支持。
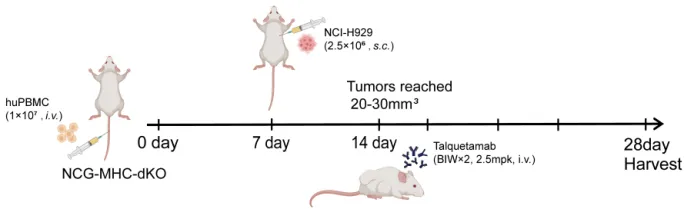
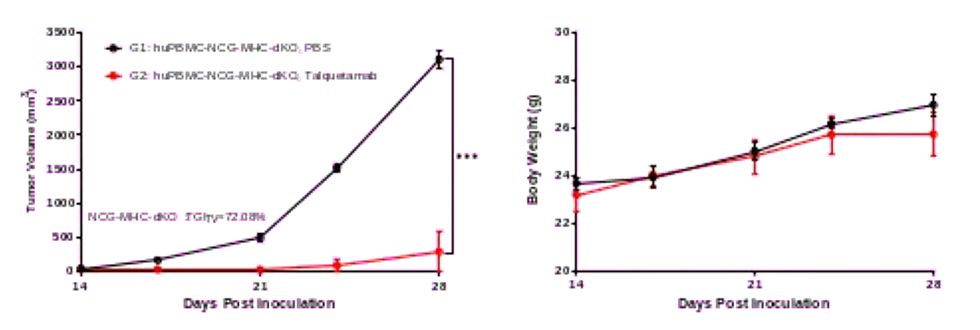
图3.Talquetamab在人源PBMC重建后的NCG-MHC-dKO模型中药效评价
Talquetamab(GPRC5D×CD3 双特异性抗体)能显著抑制NCG-MHC-dKO小鼠体内的肿瘤生长,并且治疗期间小鼠体重及状态稳定,说明NCG-MHC-dKO模型是评价CD3双抗药物的理想模型。
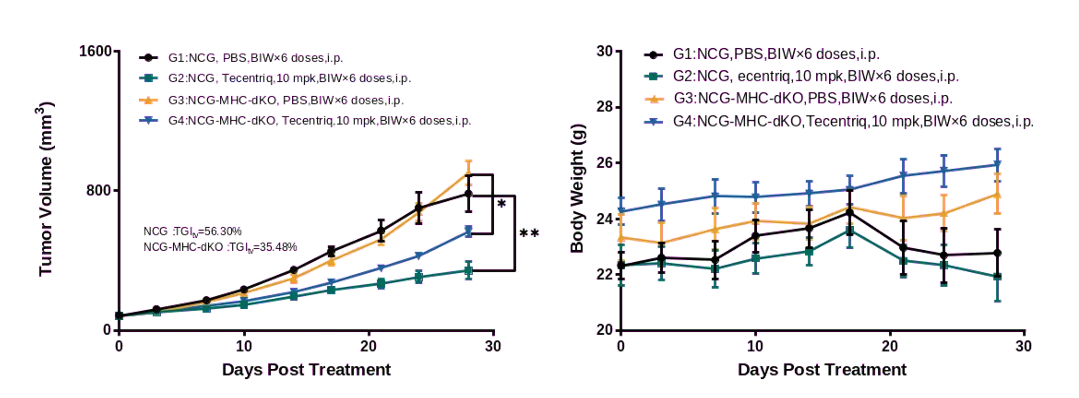
图4.Tecentriq在人源PBMC重建后的NCG-MHC-dKO模型中药效评价
Tecentriq(PDL1抑制剂)从用药开始的30天内监测体重和肿瘤的测量。结果发现Tecentriq能显著抑制NCG-MHC-dKO小鼠体内的MDA-MB-231肿瘤生长,且小鼠的体重及状态稳定。
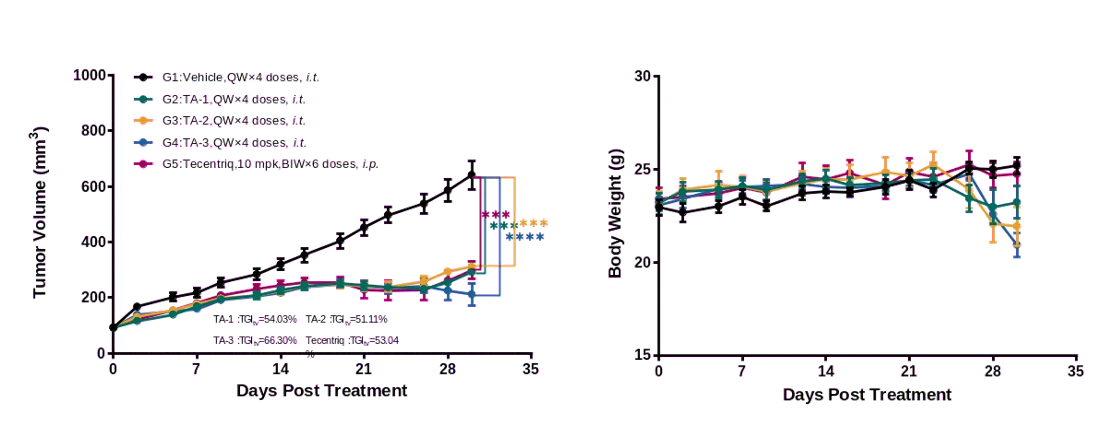
图5.人 mRNA 疫苗和 Tecentriq 在 huPBMC 重建后的NCG-MHC-dKO模型中药效评价
给予不同剂量的测试药物(TA)和 Tecentriq,从用药开始的 30 天内监测体重和肿瘤的测量。结果发现人mRNA疫苗和 Tecentriq 均能显著抑制 NCG-MHC-dKO 小鼠体内的 MDA-MB-231 肿瘤生长。
NCG-MHC-dKO小鼠模型作为一种新的实验工具,展示了在缓解人源PBMC异体移植GvHD、保持IgG抗体半衰期以及研究CD3T细胞功能及抗体药物方面的潜力。该模型为GvHD的研究提供了新的途径,并为免疫治疗策略的发展提供了重要的支持。由于huPBMC供体之间的差异性明显,为排除不同供体来源的PBMC对实验结果的影响,集萃药康通过筛选建立了huPBMC供体库,用于保证huPBMC-NCG免疫重建的稳定性。欢迎咨询深入了解。

