cGVHD新药获批上市!集萃药康解读GVHD动物模型选择及非临床评价体系
近日,Incyte和Syndax Pharmaceuticals共同宣布,FDA已批准CSF-1R单抗Niktimvo(axatilimab-csfr)上市,用于治疗慢性移植物抗宿主病(chronic graft-versus-host disease, cGVHD)。今天,集萃药康就带大家走近该全球首款获批上市的CSF-1R单克隆抗体药物,并解读GVHD动物模型选择及非临床评价体系。
Niktimvo的研制和作用
据了解,Niktimvo的获批主要基于AGAVE-201的研究数据(NCT04710576)。AGAVE-201是一项开放标签、随机多中心2期临床试验,旨在评估3种不同剂量的Niktimvo对既往接受过至少两种系统治疗的复发或难治性cGVHD患者的有效性、安全性和耐受性。
研究共纳入241例成人和儿童cGVHD患者,分别接受每两周0.3 mg/kg、每两周1.0 mg/kg和每四周3.0 mg/kg剂量的Niktimvo治疗,所有治疗队列均达到主要终点。在获批剂量0.3 mg/kg Q2W患者组中(N=79),75%的患者在治疗的前6个月内达到ORR,60%患者的病情在第12个月时仍然保持缓解。
Niktimvo是一种IgG4人源化单克隆抗体,与选择性集落刺激因子-1受体(CSF-1R)高亲和力结合,使用Niktimvo阻断CSF-1R可减少疾病介导巨噬细胞及其单核细胞前体的数量,在cGVHD的治疗中发挥重要作用。
GVHD动物模型选择及非临床评价体系
集萃药康认为,同种异体造血细胞移植是血液病治疗的有效方案,其中GVHD是最常见的并发症,发生率极高(30%-70%)。GVHD可分为急性GVHD(aGVHD)和慢性GVHD(cGVHD),通常aGVHD在移植100天内发生,cGVHD在移植100天后发生。GVHD发生机制复杂,临床表现多样,累及多个器官或组织。
人源化小鼠模型通常将人PBMC注射到免疫缺陷小鼠(如NCG)体内,能够更好地模拟人类免疫系统的反应。不同donor、是否接受辐照及辐照剂量、huPBMC注射量都会影响小鼠GVHD的临床表型。
GVHD新药研发的非临床评价策略,主要包括基于aGVHD和cGVHD的评价体系,建议根据药物的作用特点匹配合适的试验体系。GVHD的发生率和严重程度可以通过小鼠体重变化、生存率、GVHD评分和组织病理学评价等指标进行评估。aGVHD评价体系主要包括人源化小鼠模型和同种异体小鼠模型。
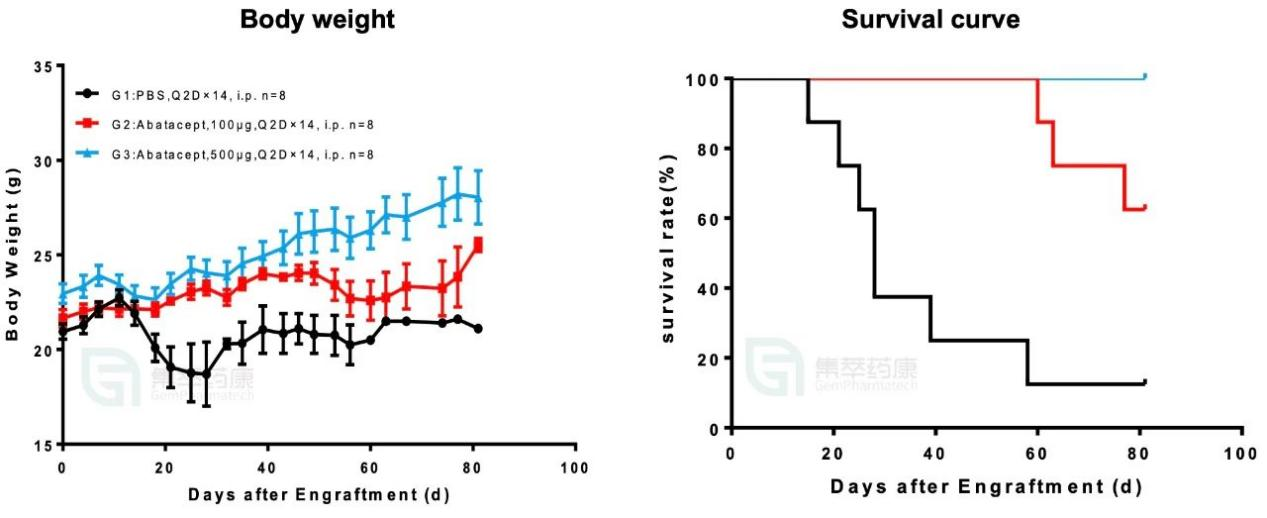
目前,集萃药康已经完成了aGVHD模型的药效验证,使用选择性T细胞共刺激调节剂Abatacept在以huPBMC-NCG小鼠构建的aGVHD模型上验证其药效,Abatacept可以改善小鼠的生存率及生存状态。
同时,集萃药康还建立了基于同种异体小鼠模型的aGVHD评价体系,并基于对GVHD动物模型和其非临床评价的深刻理解,搭建了相关的非临床评价平台,适用于不同类型药物的非临床评价场景,为新药开发提供有力支持。

