揭秘升级版SLE模型:如何用hBAFF/hCD20小鼠革新B细胞药物开发
B细胞在自身免疫性疾病中的核心地位与靶向治疗
B淋巴细胞在适应性免疫应答中扮演着核心角色,其功能失调是多种自身免疫性疾病 (Autoimmune Diseases, AIDs) 发病的关键环节。在系统性红斑狼疮 (Systemic Lupus Erythematosus, SLE) 等疾病中,自身反应性 B 细胞的异常活化、存活及抗体分泌是导致组织损伤和疾病进展的主要驱动因素。因此,靶向调控 B细胞发育、存活和功能的通路,已成为治疗SLE及其他自身免疫性疾病的重要策略。
B细胞激活因子 (BAFF/BLyS) 是肿瘤坏死因子 (TNF) 超家族成员,对维持B细胞稳态至关重要。BAFF通过与受体 BAFF-R、BCMA和TACI结合,主要促进过渡期和成熟B细胞的存活。值得注意的是,临床SLE患者常伴有血清BAFF水平的显著升高。过量的BAFF会打破B细胞耐受的平衡,支持自身反应性B细胞的异常存活与扩增,进而驱动自身免疫反应的发生和发展。另一方面,CD20是表达于B细胞表面(从前B细胞到成熟B细胞,浆细胞除外)的重要分子,是抗体药物如利妥昔单抗 (Rituximab) 作用的关键靶点。CD20抗体通过介导抗体依赖的细胞毒性 (ADCC)、补体依赖的细胞毒性 (CDC) 以及直接诱导凋亡等机制清除B细胞,从而达到治疗目的。
hBAFF/hCD20双人源化自发SLE小鼠模型的开发
为了更精准地模拟人类SLE的病理生理特征,并服务于靶向B细胞及其相关通路的药物(特别是治疗性抗体)的临床前评价,集萃药康成功开发了过表达人源BAFF (hBAFF) 的人源化小鼠模型 (B6-hBAFF, T036794)。该模型小鼠能够自发产生SLE样表型,包括高滴度自身抗体(如抗双链DNA抗体, anti-dsDNA)、免疫球蛋白升高(高丙种球蛋白血症)、免疫复合物沉积介导的肾小球肾炎(狼疮肾炎)等,高度重现了临床SLE患者的发病机制和核心临床表现。
为了进一步匹配针对不同B细胞靶点(如CD20、BCMA、APRIL等)的药物研发需求,特别是评估针对人源靶点药物的体内活性,集萃药康在 B6-hBAFF 模型基础上,构建了一系列多靶点人源化小鼠模型。其中,hCD20/hBAFF双人源化小鼠 (T065937) 整合了:
人源CD20基因 (hCD20): 替代小鼠内源性CD20,使得该模型能够直接评估靶向人CD20的治疗性抗体(如利妥昔单抗、奥法妥木单抗等)的药效和机制。
人源BAFF过表达 (hBAFF): 驱动 SLE 样疾病的自发形成,为人CD20靶向药物提供了真实的疾病背景进行评价。
hCD20/hBAFF小鼠自发SLE表型验证
与野生型对照小鼠相比,hCD20/hBAFF (T065937) 小鼠表现出典型的SLE进展特征:
血清学指标:血清中anti-dsDNA自身抗体水平以及总IgG水平均显著升高,表明系统性自身免疫反应的激活。
免疫细胞异常:脾脏和淋巴结中B细胞 (CD19+) 和抗体分泌细胞 (浆细胞) 的占比和绝对数量显著增加,反映了B细胞过度活跃和分化。
肾脏损伤: 随着周龄增长,小鼠出现显著的蛋白尿,表现为尿蛋白/肌酐比值 (UPCR) 和尿微量白蛋白/肌酐比值 (UACR) 水平的升高。
肾脏病理:肾脏组织学检查(HE 染色)显示明显的病理变化(如肾小球增生、炎症细胞浸润、新月体形成等),病理评分显著增高。过碘酸雪夫 (PAS) 染色显示肾小球基底膜增厚及基质增多,PAS 阳性表达率显著增加,符合狼疮肾炎的病理特征。
治疗验证:更重要的是,使用临床已获批的人CD20靶向抗体药物——利妥昔单抗 (Rituximab) 对患病小鼠进行治疗,能显著逆转上述多种疾病指标,初步验证了该模型在药效评价中的响应性。
利妥昔单抗在hCD20/hBAFF SLE模型中的疗效
为了系统评估人CD20靶向治疗在自发SLE模型中的效果,研究人员在8周龄的hCD20/hBAFF小鼠中开展了利妥昔单抗的药效学研究。持续给药8周后即可观察到显著的疗效,随着治疗时间延长,效果更为全面和深入(图 1):
自身抗体抑制:给药8周后,血清 anti-dsDNA 抗体水平即出现显著降低。持续给药至13-20周,血清 anti-dsDNA和总IgG水平均显著降低 (图 1A)。
肾脏功能改善:给药20周后,反映肾脏损伤的指标UPCR和UACR水平呈现降低趋势 (图 1B)。
免疫器官肿大改善:治疗显著缓解了脾脏肿大,脾脏重量明显减轻 (图 1C)。
B细胞深度耗竭: 利妥昔单抗展现出强大的B细胞清除能力。给药后,脾脏 (图 1E) 和外周血 (图 1F) 中的CD19+ B细胞以及浆细胞的数目和比例均被显著降低。
肾脏病理缓解:肾脏组织学检查显示,利妥昔单抗治疗显著降低了肾脏HE病理评分 (图 1G) 以及肾脏 PAS 阳性率 (图 1H),表明肾小球病变得到有效改善。
(Data were presented by mean±SEM.:P<0.05;:P<0.01;:P<0.001)
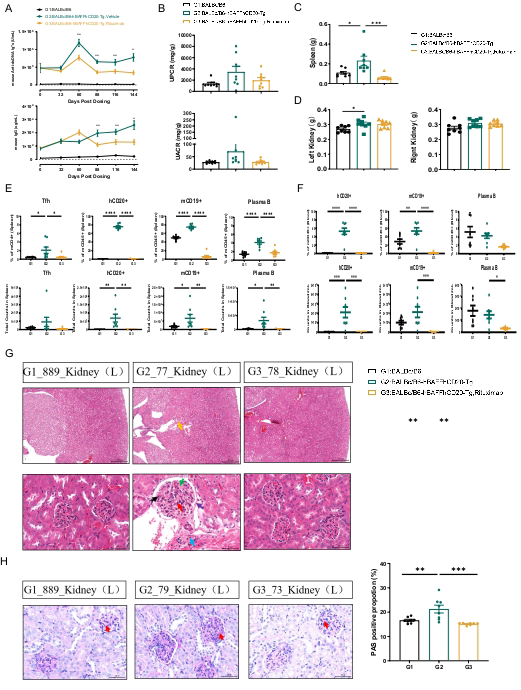
图 1:利妥昔单抗在hCD20/hBAFF人源化小鼠SLE模型中的药效评价。 (A) 血清anti-dsDNA和IgG水平变化;(B) 尿蛋白相关指标变化趋势;(C) 脾脏重量;(E, F) 脾脏和外周血中B细胞及浆细胞比例/数量;(G, H) 肾脏病理评分及PAS阳性率。数据以均数±标准误表示;P<0.05, P<0.01, P<0.001。
总结与应用前景
集萃药康成功研发的hBAFF/hCD20双人源化自发SLE小鼠模型 (T065937) 代表了临床前自身免疫性疾病研究模型的重要升级。该模型的核心价值在于:
高度临床相关性: 自发产生的SLE样疾病表型(自身抗体、高丙球、肾炎)紧密模拟了人类SLE的核心病理特征,其驱动因素(hBAFF 过表达)直接来源于临床观察。
人源靶点兼容性:整合人源CD20基因,为靶向人CD20的治疗性抗体提供了“可作用”的靶点,克服了传统小鼠模型因靶点种属差异导致的药效评价瓶颈。
强大的药效评价平台:如利妥昔单抗案例所示,该模型能敏感、全面地反映人源抗体的治疗效应,涵盖从血清学指标、免疫细胞耗竭到终末器官保护等多个层面,是评估新药、生物类似药或联合疗法效果的理想工具。
基础机制研究利器:该模型不仅是药效评价工具,更是深入研究B细胞(特别是通过BAFF-CD20轴)在 SLE发病机制中具体作用、探索耐药机制、评估不同B细胞亚群对于疾病进展的作用机制的模型,对推动自身免疫性疾病的基础研究具有重要价值。
可扩展性:作为集萃药康多靶点人源化模型平台(如hCD3/hBCMA/hBAFF, hAPRIL/hBAFF等)的重要组成部分,该模型可与其他靶点人源化模型结合,为更复杂的联合疗法或靶向不同节点的药物提供评价基础。
作为专注于创新性临床前动物模型研发的企业,集萃药康持续深耕自身免疫性疾病领域。通过构建更贴近人类疾病复杂性的基因工程动物模型,我们致力于为全球药物研发机构(工业界)和科研院所(学术界)提供精准度高、临床匹配度强的转化研究工具。这些模型将显著提升新药研发的成功率,加速自身免疫性疾病治疗药物的开发进程,并为最终实现疾病的精准治疗与临床转化提供关键驱动力。

