同样是尾静脉注射,为何它能将递送效率提升百倍?
尾静脉注射作为实验动物给药的常规方法,其操作细节已广为人知。然而,当我们深入探究其内在机制,特别是将注射对象替换为质粒DNA,一种更为精妙的基因递送技术——流体动力学注射(Hydrodynamic injection)便展现出独特优势。今天小编将系统阐述该技术的核心原理、操作关键、影响因素、应用场景及其安全性,为研究者提供深入理解和优化这一方法的参考。
定义与核心特征
流体动力学注射本质上是一种通过小鼠尾静脉,在极短时间内(5-8秒)快速注入大体积(相当于小鼠体重8%~10%)质粒DNA溶液的基因递送技术。该方法的建立可追溯至1999年Liu等科学家的开创性工作[1]。他们发现,与传统的局部注射(如肌肉注射[2])相比,这种大容积、高速率的静脉注射方式能显著提升小鼠体内转基因的表达水平,尤其在肝脏组织中。这一质粒递送系统因其特点鲜明,常被视为病毒递送系统的有效替代或补充。质粒系统转染效率相对较低且表达时间较短,但制备过程简单快捷、成本低廉,且避免了引发免疫反应的风险,安全性较高。相比之下,病毒系统虽感染效率高、表达持久,但制作纯化复杂昂贵,并存在免疫原性等潜在安全性问题。
作用原理:压力驱动的肝细胞递送
流体动力学注射的核心机制在于其产生的瞬时流体力学效应。将如此庞大的液体体积在数秒内注入静脉循环系统,会造成一系列连锁反应。首先,这导致心脏瞬时负荷过重。随之,大量含有质粒DNA的溶液主要淤积在肝脏血管床内,引起肝脏内部的压力急剧升高。这种高压环境迫使肝窦内皮细胞间的窗孔结构扩大,同时导致肝细胞膜出现暂时性的微小孔隙。质粒DNA分子正是通过这些物理性形成的通道,得以高效地进入肝细胞内部,进而启动目的基因的表达过程[3]。
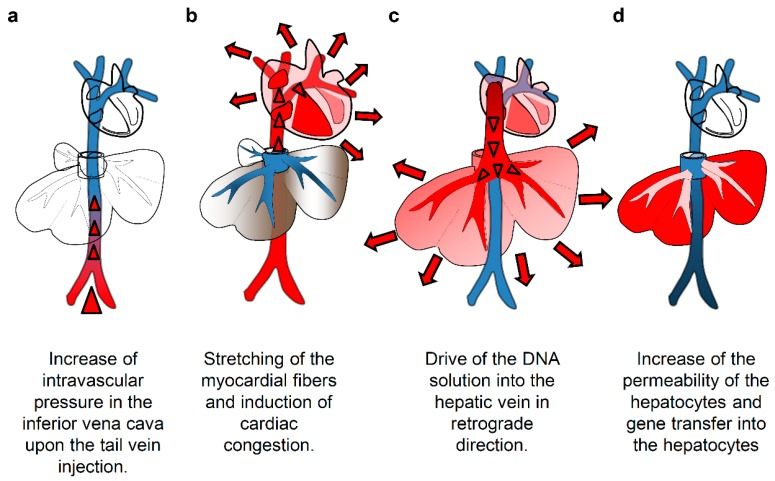
图1:流体动力学注射质粒的作用原理
操作流程与关键参数
操作层面,流体动力学注射延续了标准尾静脉注射的基本步骤(攻克小鼠尾静脉注射!3步精讲,小白变高手):包括小鼠的妥善固定、尾静脉的有效扩张以及最终的注射环节。一般尾静脉注射体积为0.05-0.1ml/10g,推注速度约为0.05-0.1ml/s,以减少小鼠应激为主。 其区别于常规注射的核心在于两个硬性参数:注射体积必须精确控制在小鼠体重的8%~10%之间,且整个注射过程需在5-8秒内迅速完成。这两个参数是实现高效基因表达的基础保障。
影响基因表达效率的关键因素
实现高效的体内基因表达并非易事,多个关键因素需协同考虑:
质粒构象的决定性影响: 质粒DNA的物理形态对其表达效能影响显著。Chen ZY等人(2001)[4]的研究揭示了一个重要规律:线性DNA(LDNA)相较于环状DNA(CDNA),在介导目的基因表达上展现出巨大优势,表达量可提高10至100倍,且表达时间可持续长达9个月。更为优化的是,若进一步去除线性DNA中的细菌骨架序列(LFDNA),不仅能进一步延长和增强转基因表达,还能显著降低机体炎症因子的产生,减轻免疫反应(图2)。
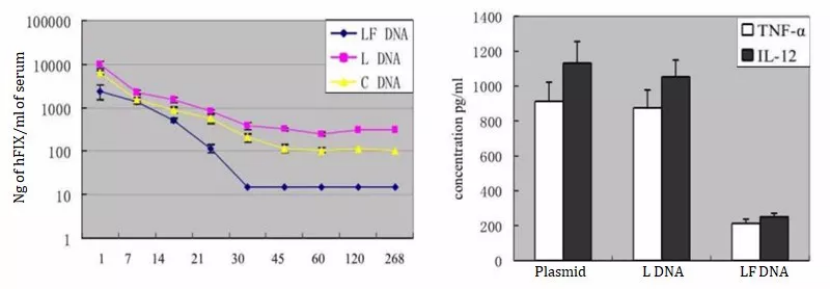
图2:左图为不同形式DNA介导的hFIX在小鼠体内的表达水平;右图为不同形式DNA在小鼠体内诱导的炎症因子水平。
注射液类型的选择: 溶解质粒DNA的溶液类型对表达效率和肝脏健康至关重要。Feng D等人(2004)[5]的细致研究表明,使用Ringer液溶解质粒可获得最高的基因表达水平,同时其对肝脏的毒性也是最小的。研究者推测这得益于Ringer液中的CaCl₂成分,可能促进了DNA的细胞内化过程。相比之下,使用PBS或生理盐水作为溶剂时,表达水平较低且对肝脏的损伤更大(表现为血清ALT升高,图3)。值得注意的是,在生理盐水中加入聚乙二醇(PEG) 被证明有助于稳定进入肝细胞的质粒DNA,并提升其向细胞核转运的效率。
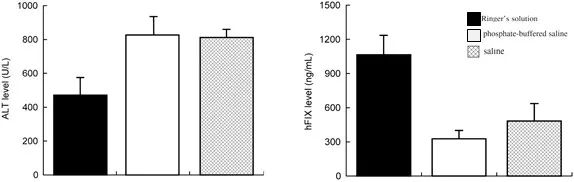
图3. 不同注射液流体动力学注射质粒8小时后,血液ALT水平(左图)及hFIX表达情况(右图)
体积配比的精确控制: 快速注射产生的大幅液体压力不仅允许外源质粒高效进入肝细胞,也会使部分质粒进入肾脏、脾脏、肺和心脏等其他组织,从而实现多器官转基因表达。由于肝脏独特的血液供应和内皮结构特性,其转基因表达水平显著高于其他器官,整体仍以肝脏为主导。注射液体积与小鼠体重的比例是调控基因表达组织分布和效率的关键参数。针对不同体重范围小鼠(如11-13g、18-20g、30-33g)的研究一致表明,当注射体积达到小鼠体重8%-10%的黄金比例时,转基因在肝脏、肾脏、脾脏、肺和心脏等主要器官中的表达效果达到最优状态。
注射速度的严格把握: 完成注射的时间窗口是另一个不容忽视的关键点。转基因表达的最佳效果要求注射在5-8秒内一气呵成(图4)。一旦注射时间拖延超过15秒,表达水平将急剧衰减甚至无法检测。然而,需要警惕的是,追求速度(尤其在大体积注射时)会加剧注射后肝脏的瞬时损伤程度。因此,在确保注射效率的前提下,精细控制注射速度以平衡表达效率与动物福利至关重要。
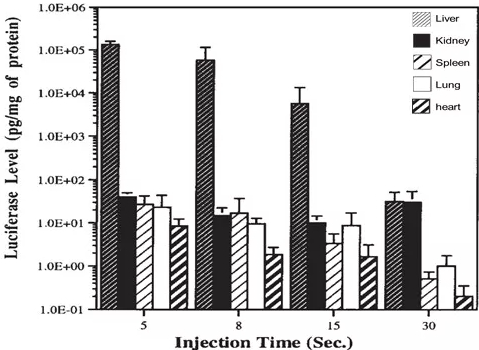
图4:不同注射时间对质粒在各组织表达水平的影响。
动物状态的细微作用: 实验动物的生理状态也能微妙地影响注射效果。研究表明,在麻醉状态下进行流体动力学注射有助于提升转基因表达。这可能是由于麻醉降低了心率和心输出量,使得快速注入的DNA溶液能更有效地逆流至肝脏,而并未额外增加肝脏毒性。此外,动物的性别(雌性可能高于雄性) 和品系(如ICR品系可能高于B6品系) 也可能在某种程度上影响表达水平,值得在实验设计中关注。
表达峰值的捕捉
成功注射后,转基因表达通常在8-24小时左右达到峰值,之后便迅速下降。这种快速衰减与质粒DNA进入肝脏后的动力学有关:最初的1-3天内表达会急剧丢失,随后的4-7天则呈现缓慢下降的趋势。因此,研究者必须根据具体实验目标(如研究急性效应还是短期表达),精确选择检测的时间窗口,以捕捉到目标表达水平。
应用领域的广泛拓展
流体动力学注射技术的应用范围早已超越了最初的质粒DNA递送。它已被证明能成功地将RNA分子、蛋白质甚至病毒载体等多种类型的大分子物质高效递送到动物体内。这种灵活性使其在多个研究领域大放异彩:它成为基因功能体内快速验证的有力工具[6],被探索用于肝脏靶向性基因治疗的研究策略[7],并且特别在构建肝癌模型方面展现了巨大价值,为癌症机制研究和治疗开发提供了重要平台[8, 9]。
安全性的审慎评估
总体而言,流体动力学注射被认为是一种相对安全的基因递送方法。注射后,小鼠因液体负荷体重会短暂快速增加,但通常在4-10小时内即可恢复正常。临床生化指标监测显示,血液中Na⁺、K⁺、Cl⁻及总蛋白浓度基本维持在生理范围内。虽然作为肝损伤标志物的血清ALT水平在注射后会短暂性升高,但这种升高通常与注射的质粒本身或表达的基因产物无关,并在3天后基本恢复正常。组织学观察发现,约5%的肝细胞在注射后会呈现可逆性损伤,伴有局部出血和坏死灶;到注射后4天左右,肝脏内出现单核细胞聚集增生,标志着修复过程的启动,肝脏结构功能逐步恢复。尤为重要的是,质粒DNA进入肝细胞后主要以游离体(episome)的形式存在,不会整合到宿主染色体中,从根本上消除了干扰内源基因或引发插入突变的风险。
展望:挑战与未来方向
流体动力学注射凭借其操作相对简便、成本效益高、安全性可控(低免疫原性、无基因组整合风险)以及在肝脏实现高效瞬时表达的独特优势,已成为基础研究领域不可或缺的基因递送工具。随着后基因组时代对基因功能深入解析的需求日益增长,安全高效的体内递送技术显得尤为重要,非病毒载体系统在此展现出独特的应用潜力。尽管目前该技术在实验动物模型(尤其是小鼠)中已相当成熟,并发展出导管辅助等改进方法,但将其转化应用于临床人体治疗仍面临重大挑战,其中最大的障碍在于人体对超大体积快速静脉注射的耐受性问题。
未来的研究焦点应集中在克服现有局限上:开发更精准的组织靶向策略以降低所需体积、探索减轻瞬时高压对器官(尤其是心血管和肝脏)损伤的方法、以及设计新型载体系统以延长转基因的稳定表达时间。通过持续深入的技术创新和机制研究,流体动力学注射技术有望迎来突破性进展,最终发展成为更安全、便捷、高效的基因治疗递送平台和功能研究利器。
参考文献
[1] Liu F, et al. Gene Ther 1999, 6:1258
[2] Wolff JA, et al. Science 1990, 247:1465
[3] Kamimura K, et al. Pharmaceutics 2015, 7:213
[4] Chen ZY, et al. Mol Ther 2001, 3:403
[5] Feng DM, et al. Clin Exp Pharmacol Physiol 2004, 31:850
[6] Kawano F, et al. Nat Chem Biol 2016, 12:1059
[7] Arad U, et al. Hum Gene Ther 2005, 16:361
[8] Chen X, et al. Am J Pathol 2014, 184:912
[9] Xue W, et al. Nature 2014, 514:380

