Nature突破:体内编辑造血干细胞,血液病迈向
2025年8月,华东师范大学、尧唐生物与上海交通大学等多个科研团队在《Nature Biomedical Engineering》上发表了一项重要研究,题为《In vivo genome editing of human haematopoietic stem cells for treatment of blood disorders using mRNA delivery》。该研究直面血液疾病治疗中的长期难题:如何绕过传统疗法中繁琐且高毒性的步骤——如造血干细胞的采集、体外改造以及化疗预处理,从而实现更安全、更便捷的基因治疗。
该研究团队自主的新型脂质纳米颗粒(LNP)通过单次或多次静脉注射,能够将碱基编辑器mRNA高效递送至体内造血干细胞(HSC),完成关键基因的精准编辑,并显著激活胎儿血红蛋白的表达。这一突破展示了体内基因编辑疗法针对包括β-地中海贫血(β-地贫)和镰状细胞贫血(SCD)在内的单基因遗传疾病实现“无需预处理、免移植”的治疗新策略。
NCG-X:体内HSC基因编辑的黄金平台
本研究的一大亮点,是借助NCG-X品系,验证LNP递送mRNA对在体人源造血干/祖细胞(HSPC)进行高效、精准碱基编辑的可行性。NCG-X品系具有多项显著优势,并在实验中发挥了关键作用:
首先,NCG-X小鼠能够真实模拟人体血液微环境。研究人员将来自健康供者或β-地中海贫血患者的CD34⁺HSPC移植至免疫缺陷型NCG-X小鼠体内,成功构建人源化血液病模型。该品系支持人源细胞的长期存活与分化,尤其是支持骨髓中人源红细胞重建,为检验基因编辑效果与安全性验证提供了理想平台。
其次,HSC-NCG-X模型实现了对基因编辑效率及多系造血重建能力的精准评估。通过静脉注射未经抗体偶联的LNP-ABE8e/sgRNA纳米颗粒,团队成功靶向骨髓中的HSPC,实现对HBG基因启动子的高效编辑(T→C),并诱导胎儿血红蛋白(HbF)强烈表达。实验结果显示,16周后小鼠骨髓及外周血的人源细胞嵌合率保持稳定,淋巴、髓系及红系等多系造血功能未受影响,充分证明该策略在高效编辑的同时不影响造血安全性。
此外,利用HSC-NCG-X品系还实现了长期疗效与安全性的同步验证。编辑后的细胞不仅长期稳定嵌合并保持多系分化能力,还表现出红细胞表型的改善,如HbF水平上升和红细胞脱核率提升。动物实验进一步显示,该LNP系统凭借其骨髓定向递送能力,几乎未出现脱靶效应,仅引发轻度、可逆且无累积的炎症反应,未检测到抗体产生,整体安全性极高。
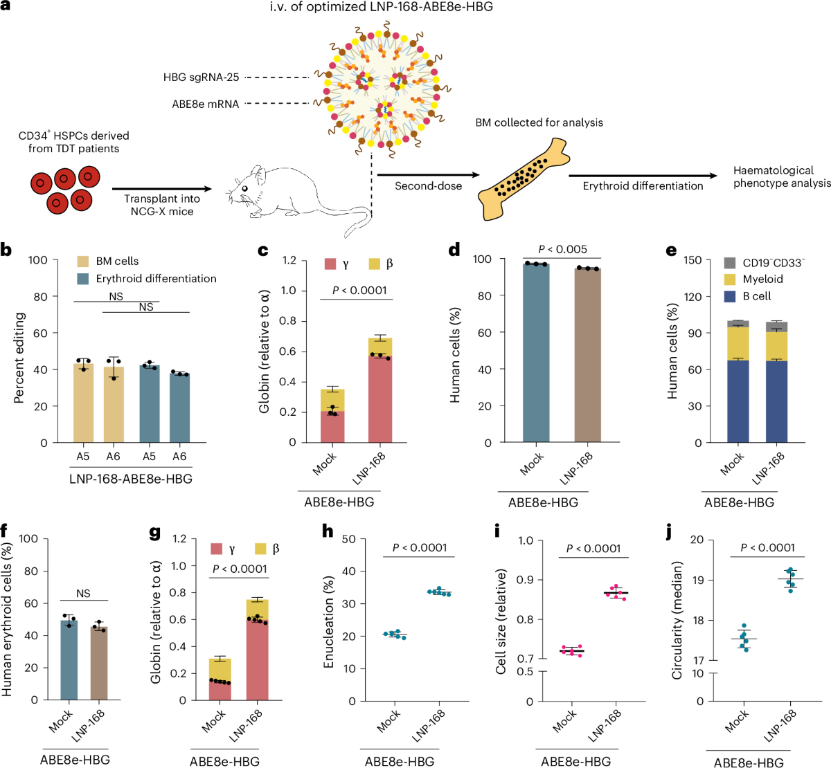
图1. LNP-ABE8e-HBG可在植入β-地中海贫血患者hCD34+细胞的NCG-X小鼠体内实现造血干细胞和祖细胞的治疗性碱基编辑
NCG-X的关键角色:从体内功能验证到临床前桥梁
NCG-X小鼠凭借其独特的重度免疫缺陷背景,骨髓微环境重塑,成为评估在体基因编辑治疗策略的核心模型工具。该品系在NCG小鼠上引入了c-kit基因点突变,导致小鼠自身造血干细胞发育缺陷,红系生成能力降低。因此,NCG-X小鼠在接受人源造血干细胞(huHSC)移植时,无需进行清髓预处理,即可支持HSC定植到骨髓,并维持骨髓中高水平的人源红系重建。这一特性使NCG-X成为一个免清髓预处理的人源化模型,显著提高了实验便捷性和可靠性。该研究中NCG-X小鼠有效衔接体外与体内实验,系统性地展示了经LNP-mRNA编辑后的人源HSC在维持高效编辑效率的同时,还具备长期多谱系造血重建能力,更在多轮全身给药实验中系统验证了LNP-mRNA制剂的安全性及长期有效性。NCG-X模型可实时监测编辑后细胞在体内的动态变化与多系分化行为,全面支撑临床转化所需的功能性和安全性证据,为后续人体试验提供了扎实的临床前依据。
总结
综上,LNP递送系统体内基因编辑,无需复杂预处理,无需干细胞移植,为β-地中海贫血、镰状细胞病等疾病的“一步治愈”带来崭新希望。除治疗用途外,该系统还可直接编辑骨髓中的HSC、免疫细胞及其他血液细胞谱系,无需构建转基因动物,为基因功能研究提供高效手段。NCG-X品系为遗传性血液病基因治疗领域提供了高质量体内模型,助力LNP-mRNA体内编辑技术的临床转化进程。NCG-X正在助力实现更安全、更普惠的CGT(细胞与基因治疗) 愿景,赋能相关研究惠及更多人群。
参考文献:
https://www.nature.com/articles/s41551-025-01480-y

