突破 UC 研究瓶颈:南京大学团队揭示新机制,动物模型助力核心验证
南京大学朱敏生教授团队在《Science》(IF=56.9)发表的突破性研究,首次揭示溃疡性结肠炎(UC)的全新起病机制 —— 新型产气单胞菌(Aeromonas sp. MTB)通过分泌毒素气溶素,选择性破坏肠道巨噬细胞屏障,为 UC 的病因探索与防治提供了颠覆性视角。该研究的核心验证依赖一系列严谨的动物实验,为从事炎症性肠病研究的科研人员提供了可借鉴的实验思路与模型应用参考。
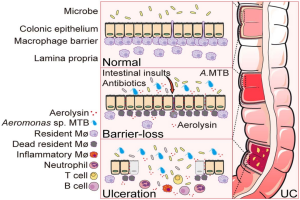
一、研究背景与核心发现
传统认知突破
UC 长期被视为上皮屏障疾病,但初始损伤因素不明。研究团队发现,UC 患者结肠组织在炎症出现前,肠黏膜巨噬细胞屏障已缺失,提示该屏障损伤是 UC 发生的早期关键事件,早于上皮屏障破坏。
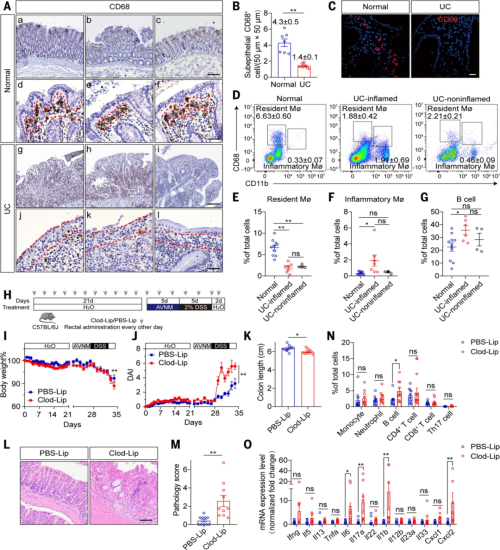
图1. 溃疡性结肠炎(UC)患者结肠上皮固有巨噬细胞缺失,导致动物对葡聚糖硫酸钠(DSS)易感性增加
致病元凶鉴定
通过筛选 UC 患者与健康人粪便样本,团队分离出新型产气单胞菌变种 “巨噬细胞毒性细菌(MTB)”。其分泌的气溶素是核心毒力因子,可特异性靶向并破坏肠道巨噬细胞,进而促进 UC 发生。
二、关键动物实验验证体系
研究团队通过多层次动物实验构建完整证据链,凸显了动物模型在机制验证中的核心价值:
1. 巨噬细胞屏障的 “许可” 作用验证
· 实验设计:特异性清除小鼠结肠巨噬细胞,对比其与对照组对低剂量 DSS 诱导结肠炎的易感性。
· 核心结果:巨噬细胞清除后,小鼠对 DSS 的易感性显著增强,证实该屏障缺失虽不直接致病,但会大幅提升肠道对损伤刺激的敏感性,是 UC 发病的关键 “许可” 因素。
2. MTB 的定植与致病条件验证
· 常规小鼠模型:单纯灌胃 MTB 无法长期定植;经抗生素预处理(模拟临床风险因素)或低剂量 DSS 造成轻微肠道损伤后,MTB 可定植≥30 天,再经 DSS 刺激即出现典型 UC 症状(体重下降、结肠缩短、溃疡形成)。
· 遗传易感模型:Il10⁻⁄⁻小鼠(经典结肠炎易感模型)单独灌胃 MTB,无需 DSS 辅助,14 天内即可诱发进行性结肠炎。
· 无菌小鼠验证:MTB 灌胃的无菌小鼠未表现出更严重炎症,证实其致病性依赖肠道菌群环境。
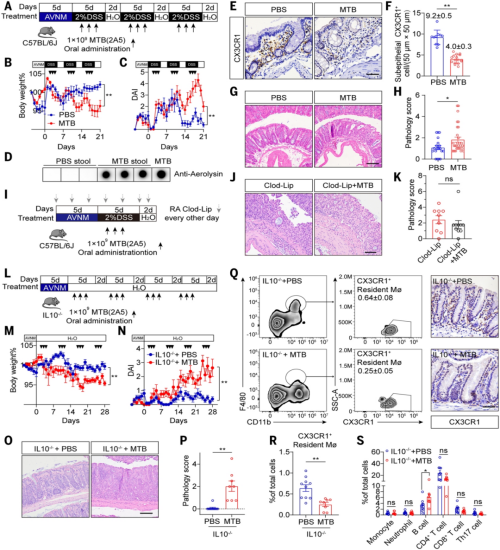
图2. MTB给药诱导溃疡性结肠炎样表型及免疫反应
3. 气溶素的必要性验证
· 基因敲除实验:构建气溶素敲除株(Δaer MTB),体外完全丧失巨噬细胞杀伤能力,体内无法引起巨噬细胞减少及结肠炎。
· 功能回补实验:向 Δaer MTB 重新导入气溶素基因后,致病能力完全恢复,明确气溶素是 MTB 致病性的必需因子。
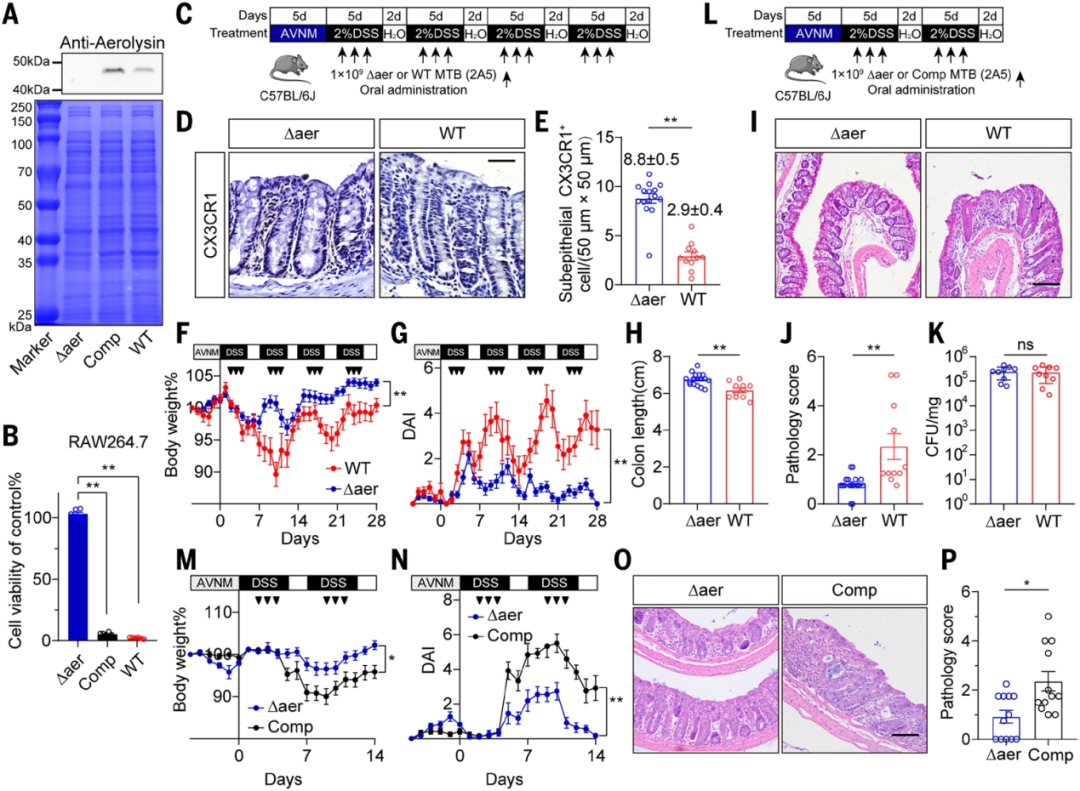
图3. 气单胞菌溶血素是MTB诱导巨噬细胞破坏和结肠炎不可或缺的因子
4. 靶向防治效果验证
· 预防试验:MTB 灌胃前给予抗气溶素多克隆抗体,小鼠完全未发生结肠炎,巨噬细胞屏障得以保留。
· 治疗试验:MTB 诱发结肠炎后给予抗气溶素单克隆抗体,疾病症状显著缓解,证实气溶素可作为治疗靶点。
三、研究意义与科研启示
临床转化价值
· 诊断层面:粪便中 MTB 或结肠组织气溶素可作为 UC 新型生物标志物,提升诊断特异性。
· 治疗层面:突破传统抗炎、免疫抑制思路,靶向清除 MTB 或中和气溶素成为全新防治方向。
实验模型应用启示
该研究的成功,依赖于巨噬细胞清除模型、Il10⁻⁄⁻遗传易感模型、无菌小鼠模型等多种动物模型的精准应用。对于科研人员而言,选择适配的模型是解析疾病机制、验证靶点有效性的关键。
药康生物深耕炎症性肠病相关动物模型研发,可提供包括基因编辑模型(如 Il10⁻⁄⁻小鼠)、巨噬细胞靶向模型、无菌小鼠模型等在内的全系列工具,搭配标准化实验技术服务,助力科研人员高效开展类似机制研究与药物研发,加速从基础研究到临床转化的进程。
本文内容为对原研究的解读,仅供参考,不构成任何医疗建议。
参考文献
Zhihui Jiang et al., An Aeromonas variant that produces aerolysin promotes susceptibility to ulcerative colitis. Science 390, eadz4712 (2025). DOI: 10.1126/science.adz4712

