无菌鼠助力丨Science 姜长涛/乔杰/雷晓光等-肠道菌群调控代谢性疾病的菌源宿主同工酶
2023年8月,北京大学姜长涛教授、北京大学第三医院乔杰院士、北京大学雷晓光教授、美国国立卫生研究院Frank Gonzalez研究员以及首都医科大学朝阳医院王广教授共同通讯在国际权威期刊《Science》上在线发表了题为“Microbial-host-isozyme analyses reveal microbial DPP4 as a potential antidiabetic target”的研究论文[1],该论文的研究人员建立了一个包含110种在各种人类疾病中起作用的酶活性筛选平台,从人和小鼠(Conv.小鼠和无菌鼠)肠道微生物群中鉴定了同工酶,包括二肽基肽酶4 (DPP4),这是治疗2型糖尿病(T2D)的重要治疗靶点。并通过使用SPF小鼠及无菌鼠(来源于集萃药康)肠壁损伤模型证明了菌源DPP4(mDPP4)可以在肠屏障损伤条件下进入肠组织,显著降低活性GLP-1水平,诱导糖耐量异常。并通过高通量筛选和结构修饰鉴定出Daurisoline的衍生物Daurisoline-d4(Dau-d4)可以抑制mDPP4的活性,在不干扰菌群整体功能的条件下,改善小鼠糖代谢紊乱。

图1.论文信息
研究人员首先建立了一套基于酶活性检测的菌源宿主同工酶探究体系(图2A),并利用该系统检测人和小鼠粪便中酶的活性,确定在110种已经报道的宿主重要疾病靶点酶中有71种在肠道菌群中存在同工酶,其中宿主二肽基肽酶4(hDPP4)的菌源同工酶(mDPP4)活性在不同个体中表现出了最强的稳定性和普遍性(图2B)。DPP4是一种丝氨酸水解酶,hDPP4可以通过水解胰高血糖素样肽-1(GLP-1)等胃肠道多肽类激素使其失活,从而调控胰岛素分泌等多种生理功能,是2型糖尿病等代谢紊乱疾病的重要干预靶点。
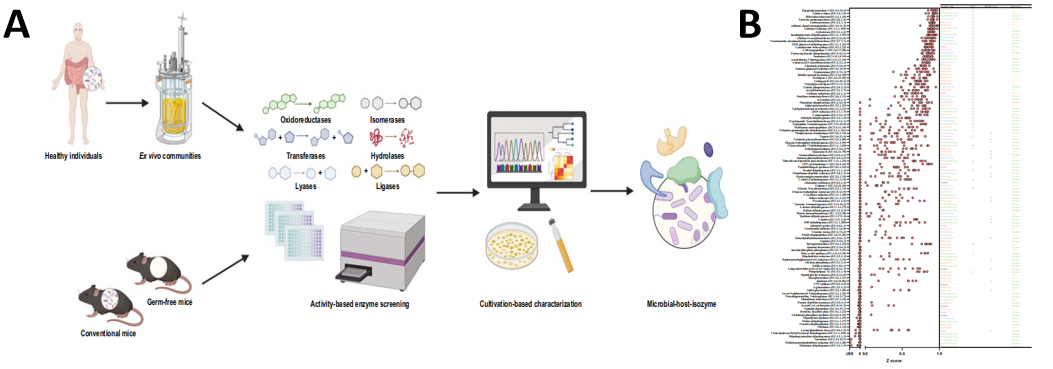
图2.酶活性筛选工作流程及结果
为了确定mDPP4是否可以发挥与hDPP4相似的生理功能,研究人员通过高脂饮食诱导、低浓度葡聚糖硫酸钠(DSS)诱导、吲哚美辛诱导小鼠发生肠屏障受损,结果发现mDPP4可以进入肠组织,显著降低活性GLP-1水平、诱导糖耐量异常(图3A)。通过人体肠道细菌分离和DPP4活性筛选,研究团队发现微生物DPP4主要由拟杆菌属细菌(Bacteroides spp)产生(图3B),其中btDPP4活性最*高(图3C)。进一步通过集萃药康DPP4编码基因敲除模型(DPP4-/-)、SPF和GF疾病小鼠模型证实多形拟杆菌可以以菌源mDPP4依赖的方式降低宿主活性GLP-1活力水平,诱导疾病小鼠模型糖耐量异常(图3D)。
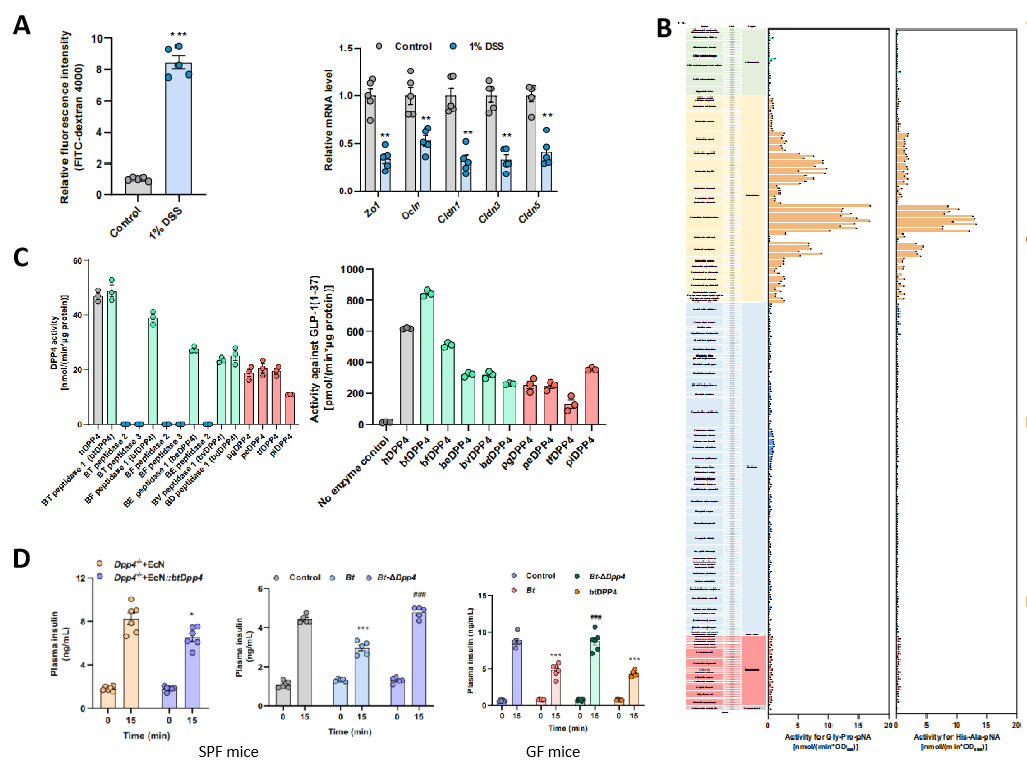
图3.多形拟杆菌可以以菌源DPP4依赖的方式诱导高脂饮食小鼠糖耐量异常相关结果
研究者进一步测试了临床相关所有DPP4抑制剂与肠菌源DPP4同工酶之间的相互作用,发现其抑制作用减弱,且并不影响多形拟杆菌生长。以西格列汀为例,其抑制btDPP4的能力只有抑制hDPP4能力的1/78(图4A)。这提示研究者,肠菌源DPP4可能也参与了2型糖尿病,因DPP4抑制剂无法对它们生效,从而导致了患者之间的疗效差异。收集分析了对西格列汀敏感(SHR)和不敏感(SLR)患者的肠菌样本,发现SLR患者肠菌中DPP4活性明显高于SHR组(图4B),且拟杆菌属丰度差异很大(图4C)。通过粪菌移植(FMT)将SLR患者肠菌移植到小鼠体内,检测到肠菌DPP4活性上升,西格列汀的疗效下降(图4D)。证实了研究者的猜想。
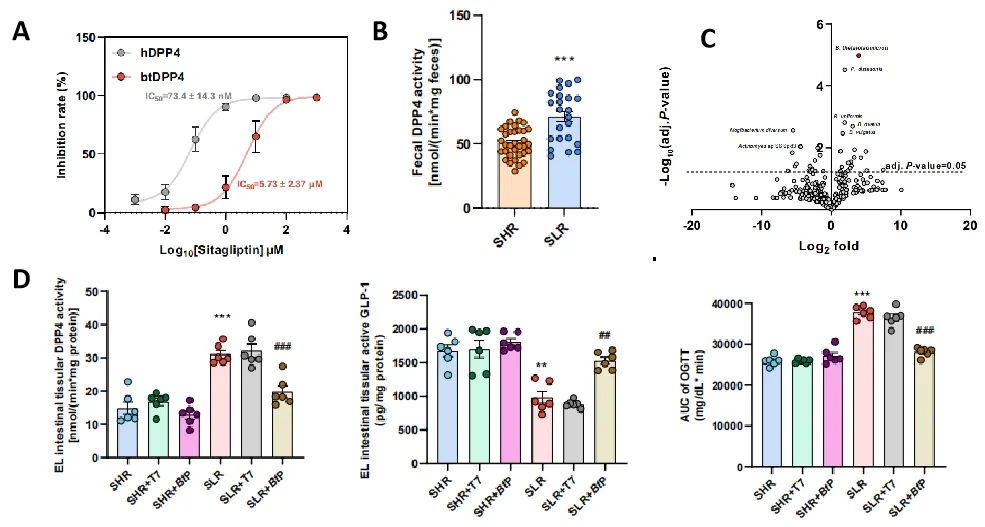
图4.肠菌源DPP4对2型糖尿病差异化治疗效果的影响
为了解决临床相关DPP4抑制剂无法抑制肠菌源DPP4作用的问题,研究者通过高通量筛选,从107000种小分子化合物库中找到了特异性微生物DPP4抑制剂Dau-d4,与btDPP4结合的KD达到0.27μM,而西格列汀为12.6μM(图5A)。在疾病小鼠模型中,Dau-d4能有效改善糖耐量,和西格列汀联用则能进一步增强治疗效果(图5B)。
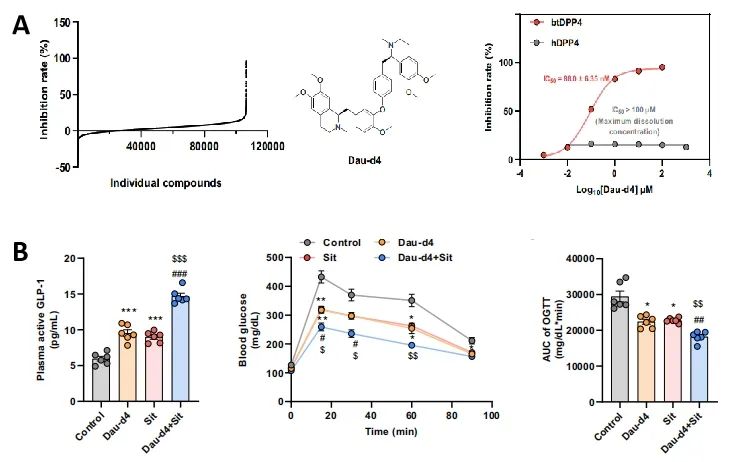
图5.Dau-d4能特异性抑制肠菌源DPP4改善糖耐量
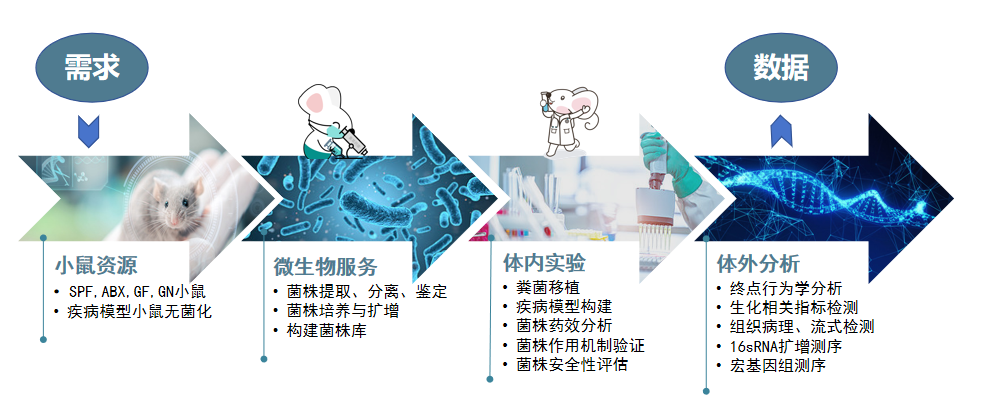
肠道菌群与机体健康、疾病治疗之间有着复杂多样的关系,SPF小鼠、无菌鼠、基因编辑小鼠模型及FMT技术作为重要的研究工具和手段越来越多地出现在各大权威期刊上。江苏集萃药康拥有品系齐全的基因编辑小鼠模型,无菌鼠与菌群研究服务平台拥有国内领先的无菌鼠生产规模和FMT操作技术,可承接菌群与代谢、菌群与炎症、抗肿瘤药与菌株联合评价、基因与菌群互作、疾病造模等多种类型项目,实现菌株进、数据出的一站式服务。欢迎咨询合作。
参考文献:[1] Kai Wang et al. ,Microbial-host-isozyme analyses reveal microbial DPP4 as a potential antidiabetic target.Science381,eadd5787(2023).

