PNAS|无菌鼠助力探究Ec-TMU缓解肠炎、调节肠道免疫稳态新机制
天津市免疫学研究所,天津医科大学基础医学院王荃教授和姚智教授近期合作在PNAS发表了题目为“Bacterialindole-3-lactic acid affects epithelium-macrophage crosstalk toregulate intestinal homeostasis[1]” 的研究论文,第 一作者为天津医科大学基础医学院免疫学系博士于开源。该研究通过对移植了服用了替硝唑患者的粪菌但对葡聚糖硫酸钠(DSS)具有不同抵抗性的小鼠粪菌进行主成分分析,筛选获得一株兼性厌氧细菌-大肠杆菌Ec-TMU,并通过集萃药康无菌(GF)小鼠、CCR2-KO小鼠等动物模型;流式检测、病理分析、免疫荧光等技术手段验证了Ec-TMU的色氨酸代谢物吲哚-3-乳酸(ILA)可以通过AHR下调糖酵解、NF-κB和HIF信号通路,抑制炎症环境中的上皮细胞产生CCL2/7,减少促炎型巨噬细胞在结肠组织的累积,调节肠道稳态的作用。
图1.文章信息
为了研究肠道兼性厌氧菌在肠道稳态中的作用,研究人员首先将服用了替硝唑患者的粪菌移植到小鼠体内,并使用DSS进行肠炎诱导,结果发现一部分小鼠出现了肠炎表型(TNZ-S),另一部分则没有(TNZ-L),进一步对这两组小鼠的粪菌进行16sRNA测序,结果差异不大,但主成分分析(PCA)发现三组菌株组成的差异体现在属水平上(图2A),其中TNZ-L组专性厌氧菌丰富度降低,兼性厌氧菌的丰富度增加(图2B),具体差异如图2C所示。随后研究人员通过动物实验考察了这些差异菌属的抗炎效果,发现Ec-TMU的效果最 好,将其定殖到GF小鼠体内后使用DSS处理,发现可以降低GF小鼠的疾病评分,改善肠部炎症(图2D)。
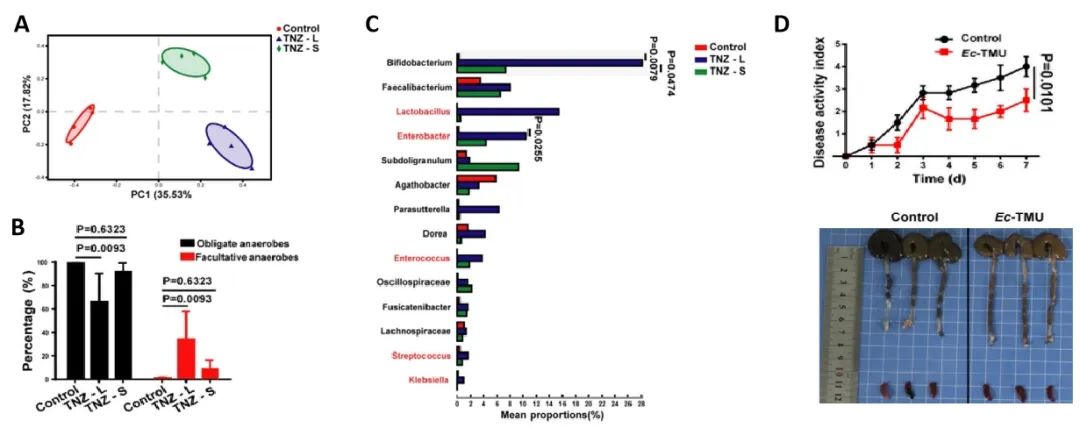
图2.Ec-TMU可以缓解DSS引起的肠部炎症
考虑到肠炎和肠道免疫系统的密切关系,研究人员分析了结肠固有层的免疫细胞表达情况,结果发现Ec-TMU组巨噬细胞表达量下降,其中促炎型巨噬细胞(P1/P2)比例减少,抑炎型巨噬细胞(P3/P4)比例增加(图3A),免疫荧光结果表明这是因为Ec-TMU上清液(分子量分数小于3kDa)中的代谢产物显著抑制了结肠上皮细胞中化学因子CCL2和CCL7的表达(图3B)。Ec-TMU上清液的PCA结果显示,与脑心输液培养基(BHI)组、K12(Ec-TMU相同种的一种菌属)组相比,其色氨酸代谢产物吲哚-3-乳酸(ILA)比例显著升高(图3C),体内外结果表明ILA对CCL2和CCL7的表达有显著的抑制作用(图3D),可以缓解DSS诱导的肠炎(图3E),这是因为ILA降低了CCR2+P1/P2巨噬细胞的比例,并通过向CCR2−/−小鼠中补充ILA和CCR2+/+巨噬细胞(图3F)证明了ILA通过降低结肠上皮细胞中促炎巨噬细胞的积累来改善炎症表型。
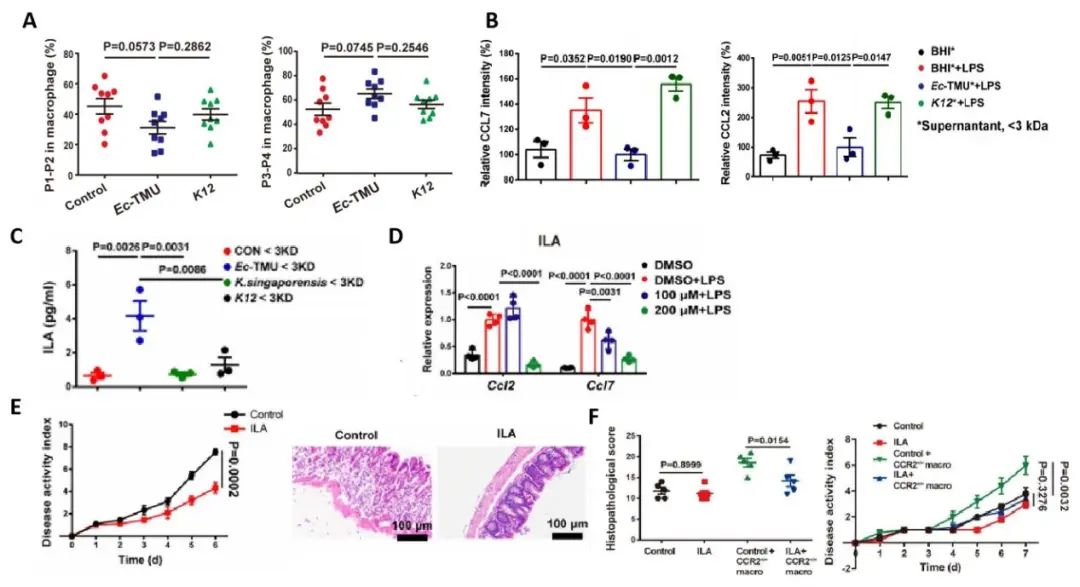
图3.Ec-TMU代谢物ILA通过降低结肠上皮细胞中促炎巨噬细胞的积累来缓解炎症
为了探究ILA影响CCL2/7表达的分子机制,研究人员对经LPS和LPS+ILA处理的SW480细胞进行RNA测序分析,结果发现LPS+ILA组中与糖酵解、HIF和NF-κB信号通路相关的基因表达显著下调(图4A),向培养液中加入NF-κB激动剂(PMA)、糖酵解激动剂(Oli)、HIF激动剂(ML)、NF-κB抑制剂(BAY)、糖酵解抑制剂(DCA)、HIF抑制剂(PX)、AHR抑制剂(CH),会消除掉ILA对CCL2/7表达的抑制作用(图4B),证明了ILA抑制炎症环境中的上皮细胞产生CCL2/7是通过AHR下调糖酵解、NF-κB和HIF信号通路实现的。
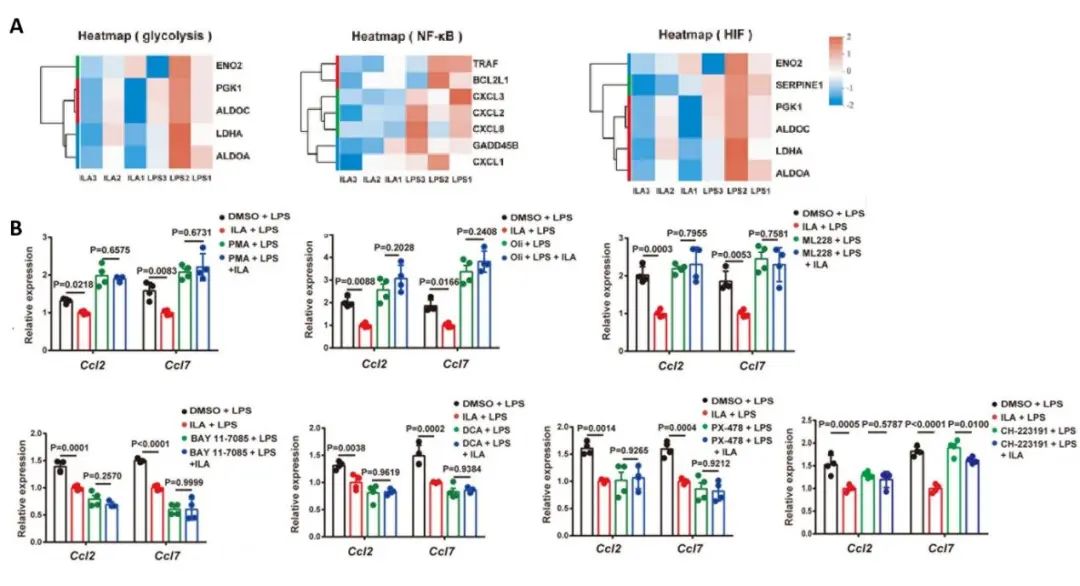
图4.ILA 通过AHR下调糖酵解、NF-κB和HIF信号通路从而抑制炎症环境中CCL2/7的产生
炎症性肠病(IBD)是一类与免疫稳态失调密切相关的肠道炎性疾病,在我国发病率呈上升趋势,本研究提出了肠道共生细菌调节肠道免疫稳态的新机制,为IBD的治疗提供了潜在策略。
肠道菌群与机体健康、疾病治疗之间有着复杂多样的关系,SPF小鼠、GF小鼠、基因编辑小鼠模型及FMT技术作为重要的研究工具和手段越来越多的出现在各大权威期刊上。江苏集萃药康拥有品系齐全的基因编辑小鼠,无菌鼠与菌群研究服务平台拥有国内领先的无菌鼠生产规模和FMT操作技术,可承接菌群与代谢、菌群与炎症、抗肿瘤药与菌株联合评价、基因与菌群互作、疾病造模等多种类型项目,实现菌株进,数据出的一站式服务。