集萃成章丨南京大学闫超、刘翔宇、陈迪俊、陈张朋团队揭示脂质堆积的反应性星形胶质细胞加速了癫痫病发展进程
2023年3月,南京大学生命科学学院闫超教授、陈迪俊教授联合南京鼓楼医院刘翔宇主任团队在Nature Neuroscience在线发表题为“Lipid-accumulated reactive astrocytes promote disease progression in epilepsy”的研究论文。该研究采用集萃药康B6/JGpt-Apoeem1Cd82/Gpt、B6/JGpt-Apoeem1Cflox/Gpt-Aldh1l1em1Cin(CreERT2)/Gpt小鼠,首次报道了一种脂质堆积的反应性星形胶质细胞(LARA)在癫痫病发病中的重要作用以及致病机理,揭示了LARA以APOE依赖的方式形成,加剧神经元的过度兴奋,促进癫痫病发展进程,为耐药TLE治疗提供新思路。
1、颞叶癫痫患者及癫痫病小鼠模型脑内脂质异常积聚
研究者首先分析了4位耐药TLE(最常见的局灶性癫痫形式)患者核磁共振波谱数据发现,与正常侧相比,TLE患者致痫侧中检测到脂质信号明显增加,表明脂质在癫痫脑中异常积聚。接下来,研究者利用免疫荧光染色以及脂质组学分析的方法发现在耐药TLE患者的神经元和星形胶质细胞中脂质积累水平显著增加。
随后通过向小鼠的海马区及腹腔注射海人酸(KA)诱导小鼠癫痫模型,然后通过组织荧光染色、脂质组学分析以及电镜切片观察等方法证实了癫痫小鼠出现了与TLE患者相似的结果,即神经元和星形胶质细胞中脂质出现异常积聚,但在小胶质细胞或少突胶质细胞并没有。
人和鼠的数据均表明,大脑中脂质的过度积聚是癫痫的一个重要病理特征(图1)。
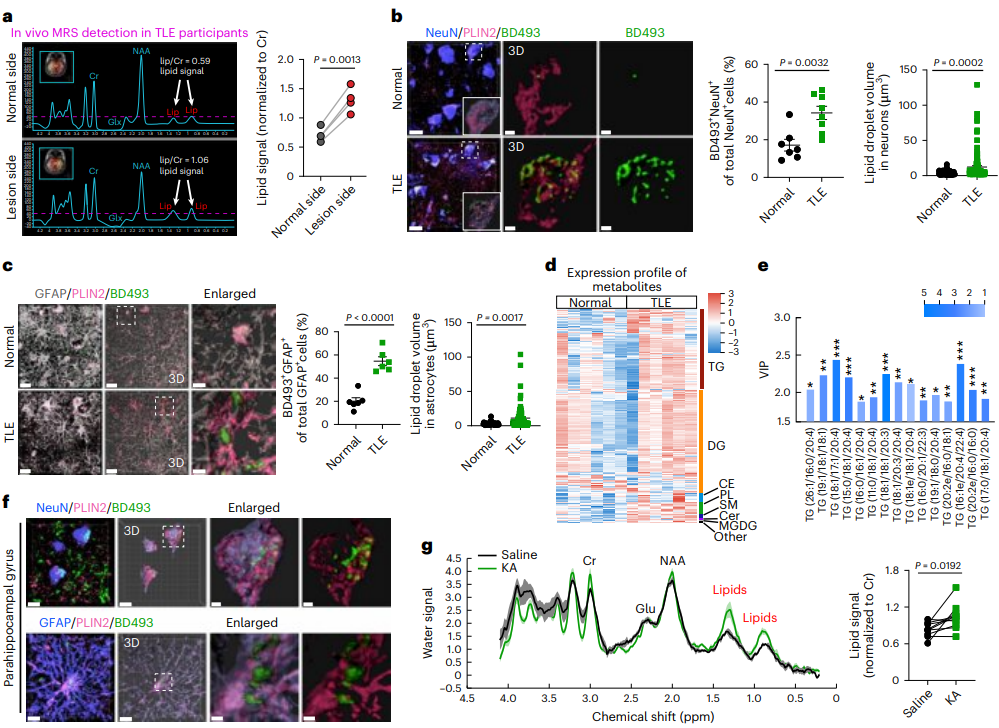
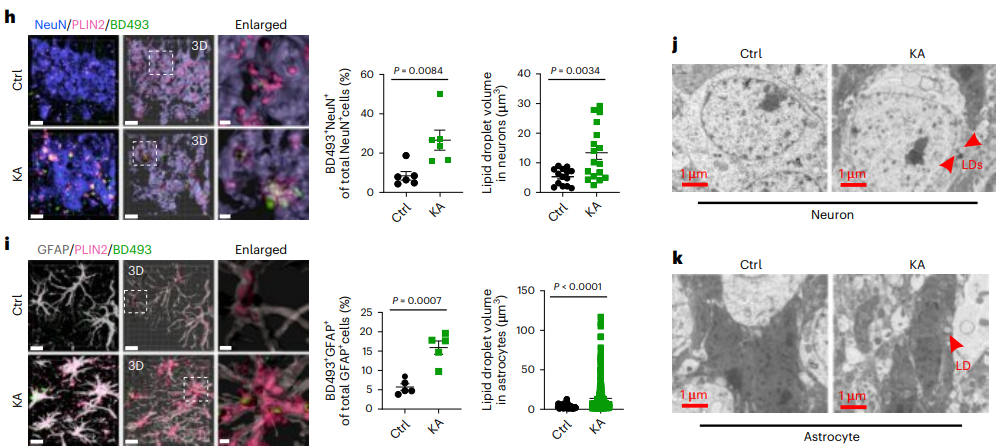
图1.癫痫患者和小鼠模型的异常脂质积聚
2、单核RNA测序揭示颞叶患者星形胶质细胞的脂质代谢异常和APOE上调
为了探究异常的脂堆积是否会导致脂代谢相关基因的表达变化,研究者使用TLE患者(n=4)和非TLE对照(n=4)的脑皮层样本进行了单核RNA测序(snRNA-seq),分析发现TLE实验组的脂质转运相关和代谢相关通路在星形胶质细胞中被显着激活,在神经元被适度激活;进一步的差异表达分析发现,TLE患者脂质转运基因APOE(编码载脂蛋白E)在星形胶质细胞中显著高表达。
这些数据表明,颞叶患者星形胶质细胞的脂质代谢异常,并确定APOE是参与这一过程的关键基因(图2a)。
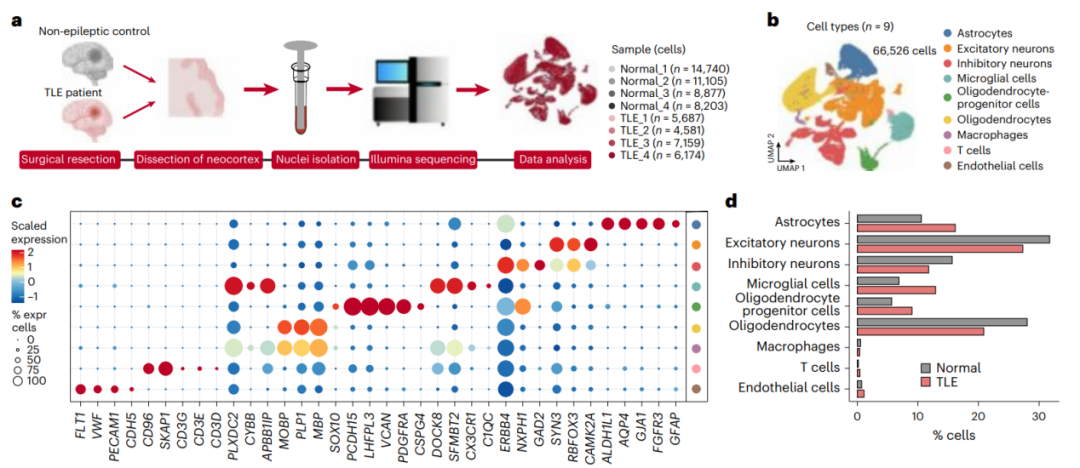
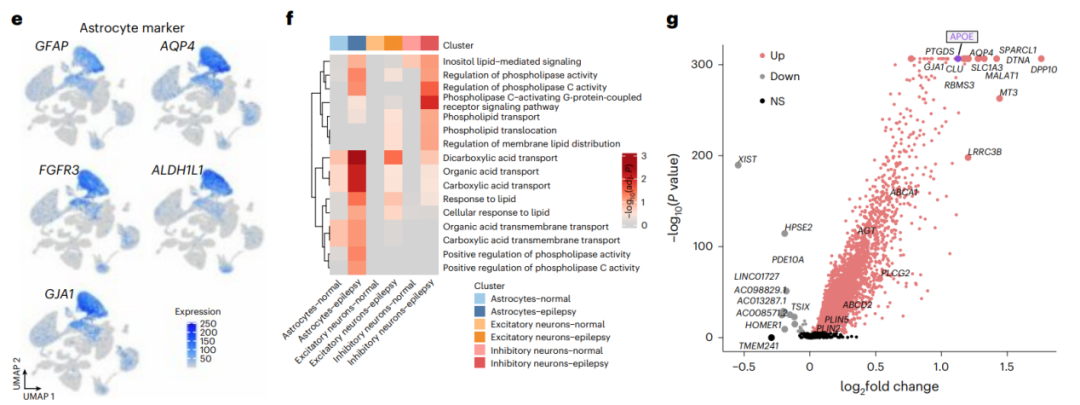
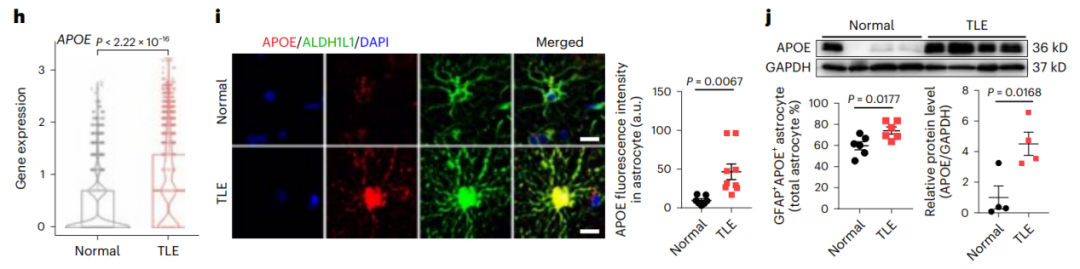
图2.单核RNA测序揭示颞叶患者星形胶质细胞的脂质代谢异常和APOE上调
3、APOE介导脂质从神经元到星形胶质细胞的转移
为了探究APOE高表达是否是星形胶质细胞脂质堆积的必要条件,研究者首先对APOE−/−小鼠注射KA诱导癫痫,并评估了施加KA刺激后21dAPOE敲除小鼠海马区脂质积聚的变化。结果发现,KA刺激仅轻微影响了APOE−/−小鼠海马区神经元脂滴(LDs)的形成;而海马区星形胶质细胞的脂质积聚在很大程度上被阻断,表明APOE是星形胶质细胞脂质积聚所必需的,而非神经元中的脂质堆积所必需的。
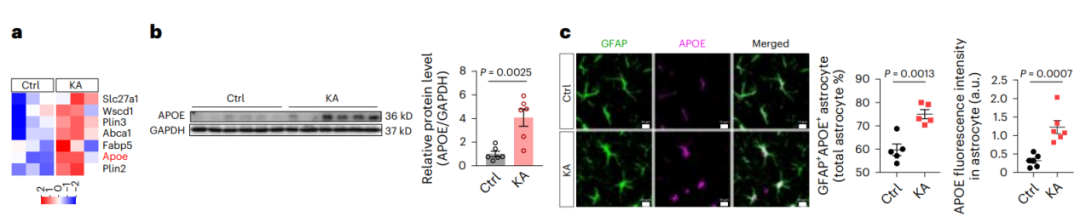
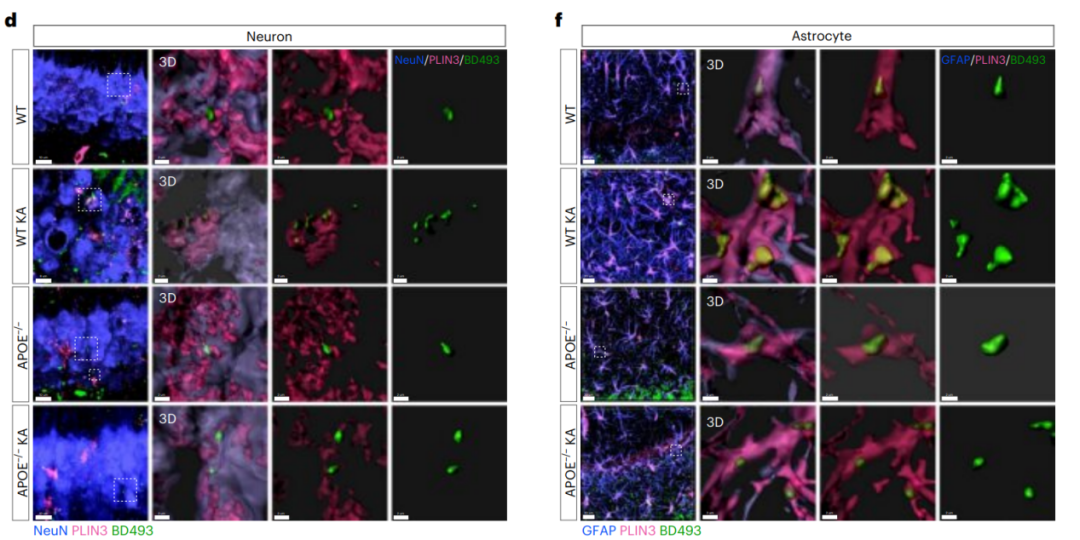
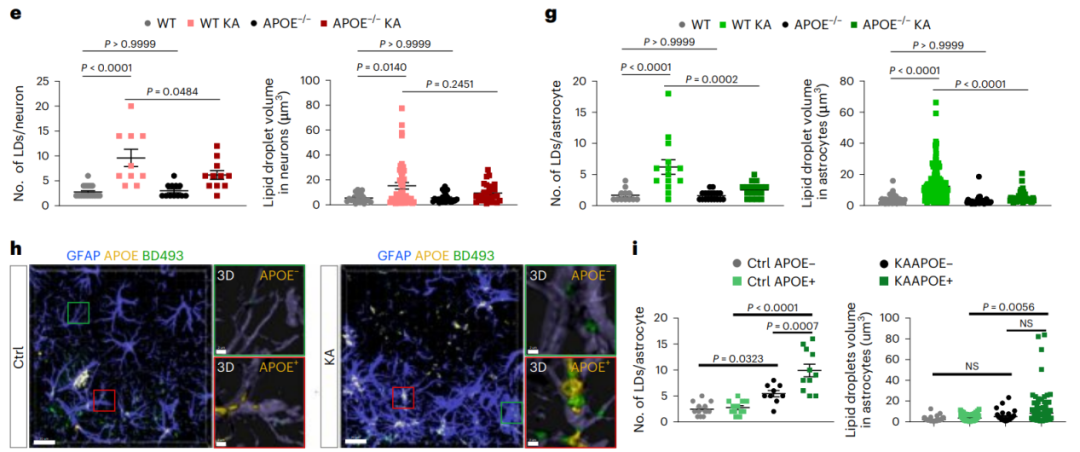
图3.癫痫小鼠星形胶质细胞脂质积聚需要APOE
基于上述结果,研究者假设,在慢性癫痫条件下,脂质最初在神经元中积累,然后通过APOE依赖性机制持续转移到星形胶质细胞。
为了验证这一假设,研究者首先开展了体外实验。将野生型或APOE−/−小鼠的原代海马神经元和星形胶质细胞体外共培养。发现KA刺激能够诱导神经元过度激活从而释放脂肪酸(FAs),释放的FAs会被临近的星形胶质细胞吸收,导致星形胶质细胞内脂质过度积聚;而当施加KA刺激APOE−/−小鼠神经元细胞时,星形胶质细胞中仅观察到较低的脂质积累水平(图3)。
接下来,研究者通过将ALDH1L1-CreERT2小鼠与APOE flox小鼠杂交,实现在星形胶质细胞中 特异性敲除APOE。在KA刺激下APOE条件性敲除鼠表现出星形胶质细胞钟LDs积累显著减少,而神经元的脂质积累水平没有明显变化。
总之,这些数据表明,在癫痫条件下,APOE介导脂质从神经元向星形胶质细胞的主动转运(图4)。
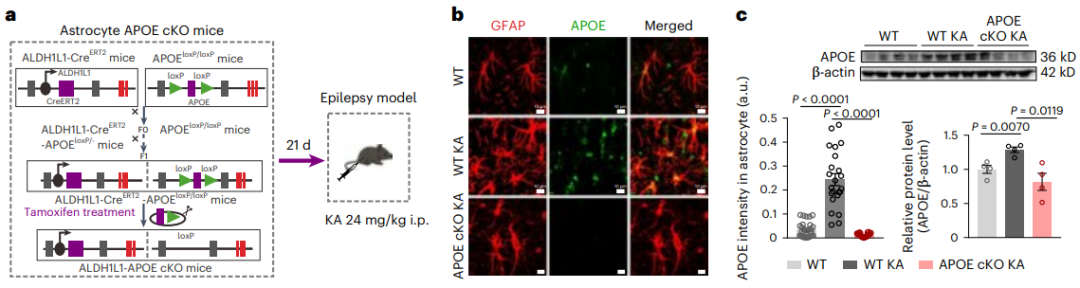
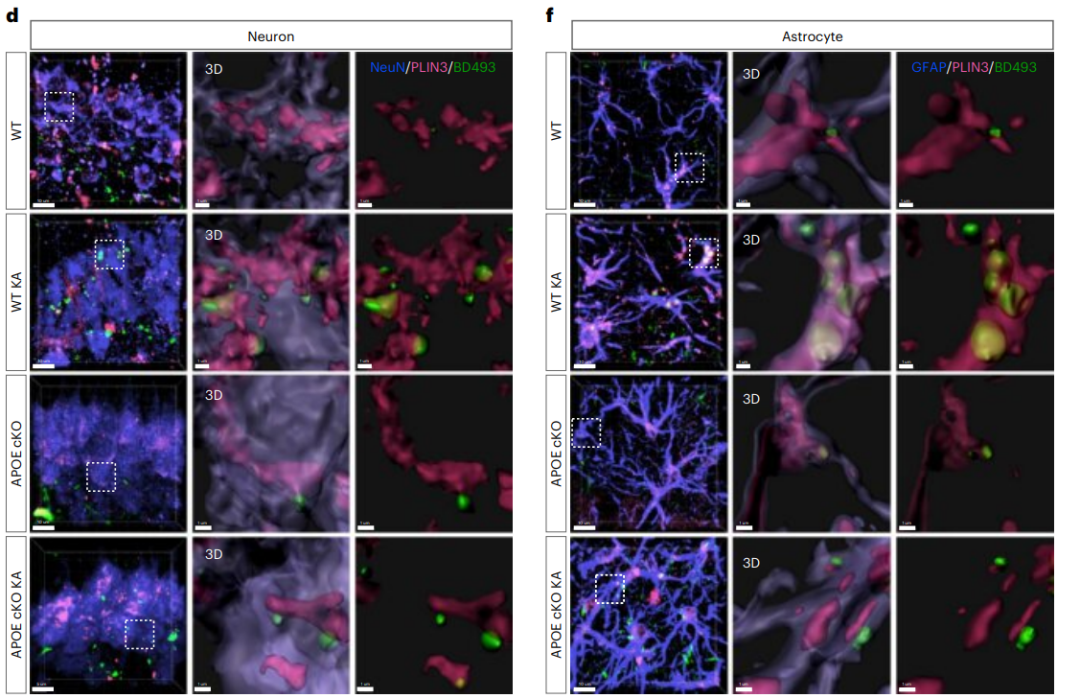
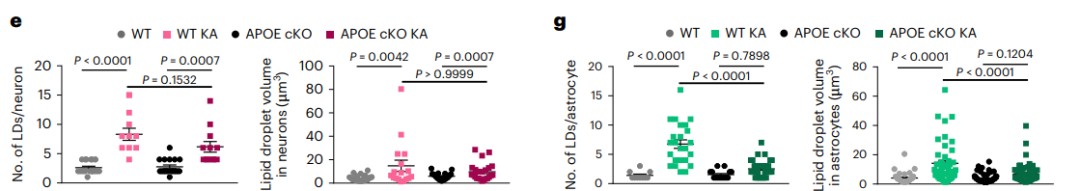
图4.星形胶质细胞特异性敲除APOE阻断癫痫小鼠星形胶质细胞脂质积聚
4、颞叶癫痫患者反应性星形胶质细胞的分子谱分析
那么这群高表达APOE并且脂异常堆积的星形胶质细胞是否是一种特定的星形胶质细胞亚群?
研究者依据对照组和TLE患者的单核RNA测序比对数据将星形胶质细胞群体分为六个亚群,分析发现,其中A4亚群既表现出脂质代谢和转运相关基因的显著高表达,同时也表现出最高的APOE表达水平;另外,通过对六个细胞亚群的标记基因的表达模式分析发现,A4亚群存在独立于其他亚群的转录组特征,是一种全新的细胞亚型,研究者将其命名为LARA(图5)。
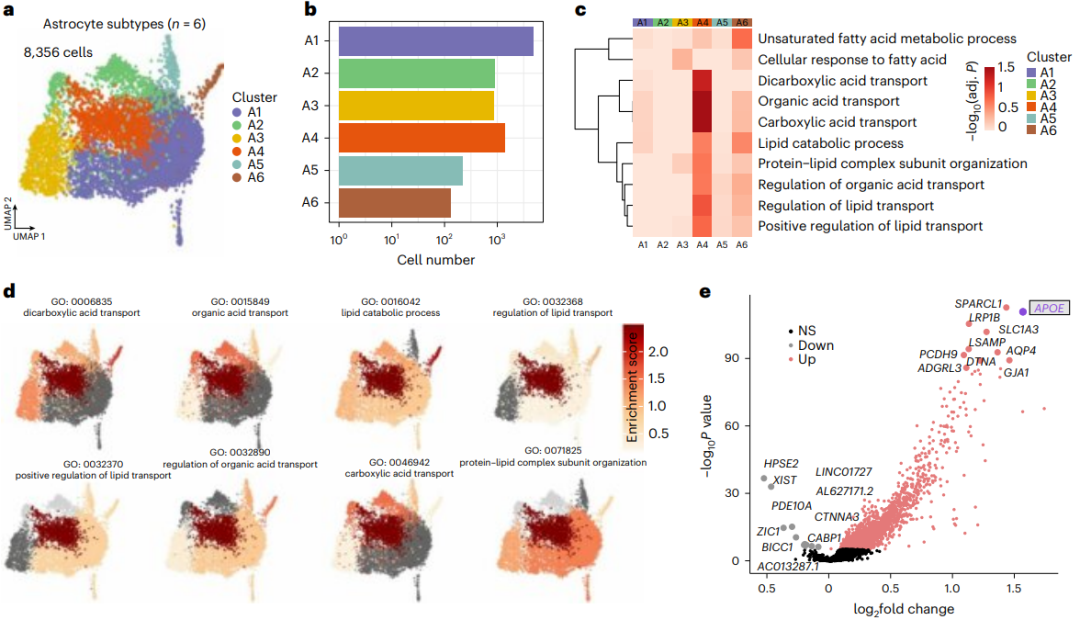
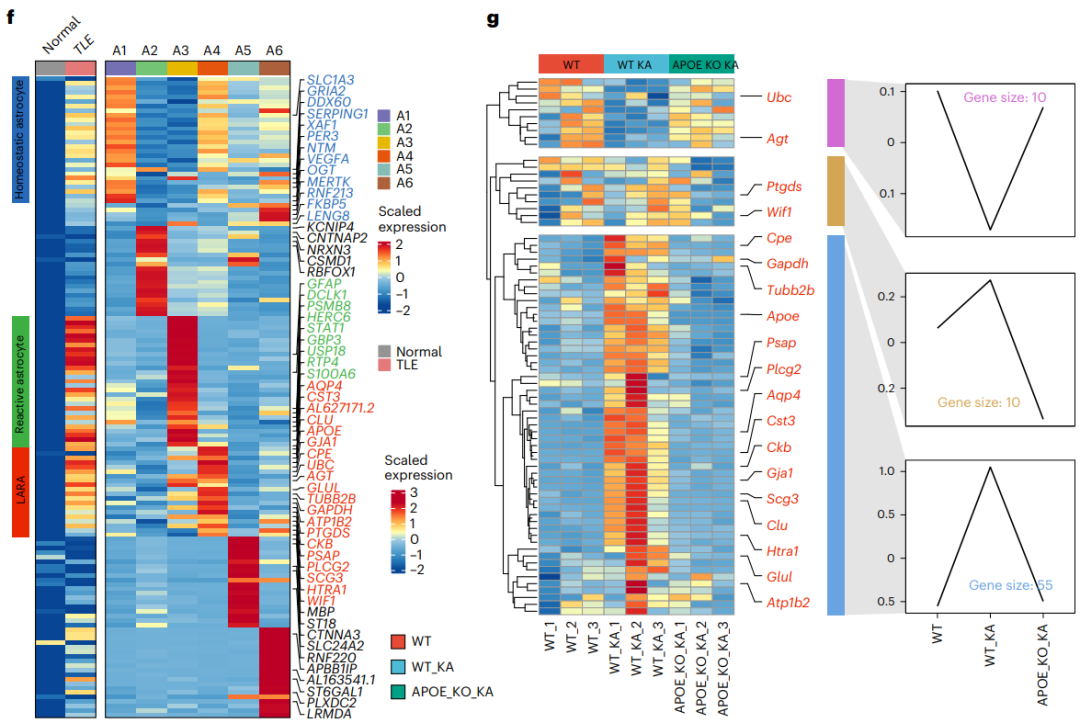
图5.载脂蛋白E介导脂质积聚反应性星形胶质细胞的形成
5、APOE是脂质积累反应性星形胶质细胞形成所必需的
那么LARA与高表达的APOE之间存在什么联系呢?研究者接下来检测了野生型、APOE−/−小鼠海马区的LARA相关基因的表达,发现77个被检基因中有65个基因在KA刺激后表现出显著变化,而在这65个基因中,又有55个基因被KA刺激上调并被APOE敲除抑制,10个基因表现出相反的模式。这些数据表明,APOE是影响LARA相关基因表达的关键因子,是LARA形成的必要条件(图5g)。
6、脂质积聚的反应性星形胶质细胞与癫痫小鼠的癫痫活动有关
接下来,研究者对LARA在颞叶性癫痫中的功能表型进行了探究。发现与KA刺激的野生型小鼠相比,无论是APOE KO还是星形胶质细胞特异性敲除APOE均能改善颞叶性癫痫小鼠的癫痫发作次数和持续时间。证明了APOE介导的脂质转运在促癫痫中发挥重要作用,同时由于LARA形成依赖于APOE,进一步说明LARA具有促癫痫作用(图6)。
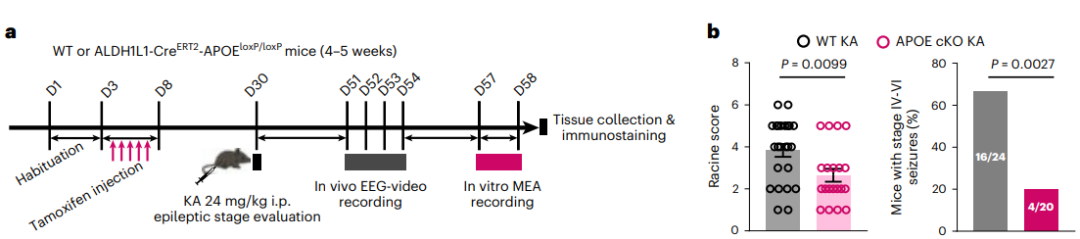
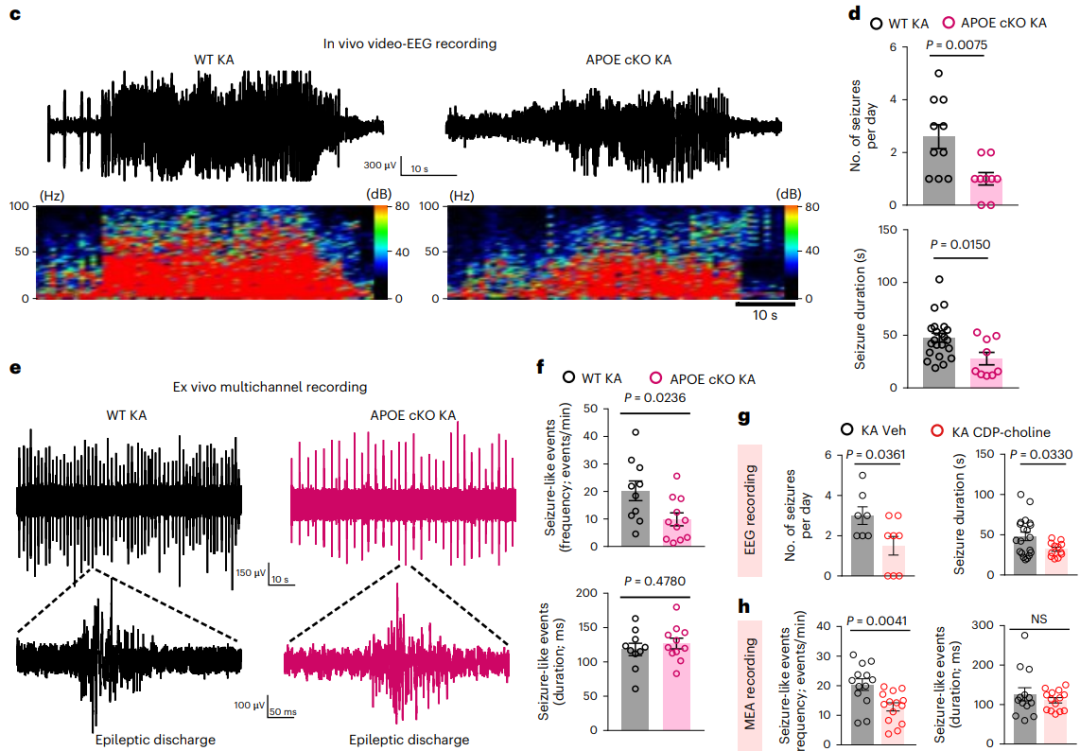
图6.脂质积聚的反应性星形胶质细胞与癫痫小鼠的癫痫活动有关
7、脂质积累的反应性星形胶质细胞通过星形胶质细胞A2AR促进癫痫活动
那么LARA是通过何种分子机制来调控、促进癫痫病发病呢?研究者通过使用游离FAs处理野生型或APOE−/−小鼠的原代星形胶质细胞,在体外模拟LARA的形成。采用RNA-seq分析发现FAs能够显著诱导腺苷2A受体(A2AR)表达上调,并且这种上调能够被APOE KO所阻断,同时,这一结果在KA诱导的癫痫小鼠海马区的免疫荧光分析结果中得到了进一步证实。
接下来为了进一步验证A2AR在促癫痫中的作用,研究者构建了AAV-A2AR-shRNA-eGFP小鼠模型实现在星形胶质细胞中 特异性敲低A2AR,当施加KA刺激后,与A2AR敲低星形胶质细胞相邻的海马区神经元兴奋性和神经传递显著降低,从而显著降低了KA诱导的癫痫发作活性。
另外,研究者通过外源施加A2AR拮抗剂ZM241385抑制A2AR的表达,结果发现抑制A2AR的表达确实能够显著降低癫痫发作活性。这些结果表明,腺苷2A受体(A2AR)在LARA介导的神经毒性中发挥着核心作用。
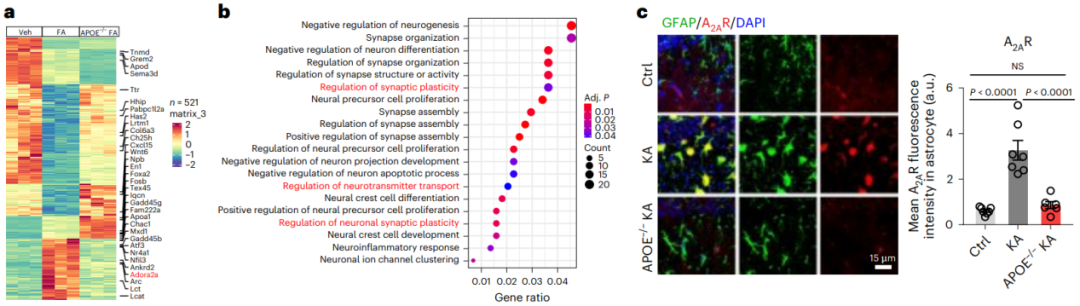
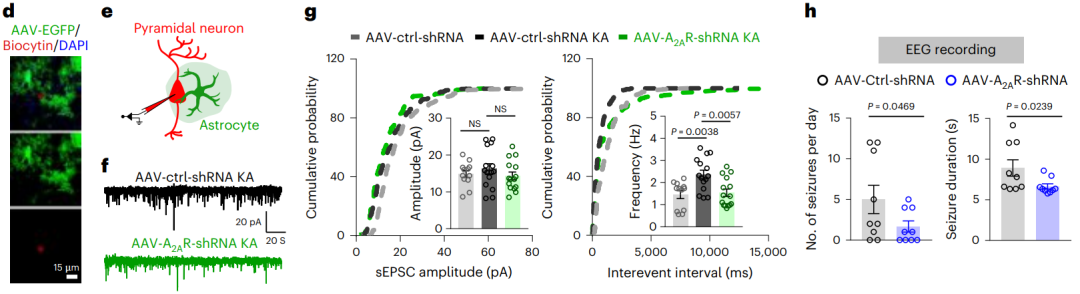
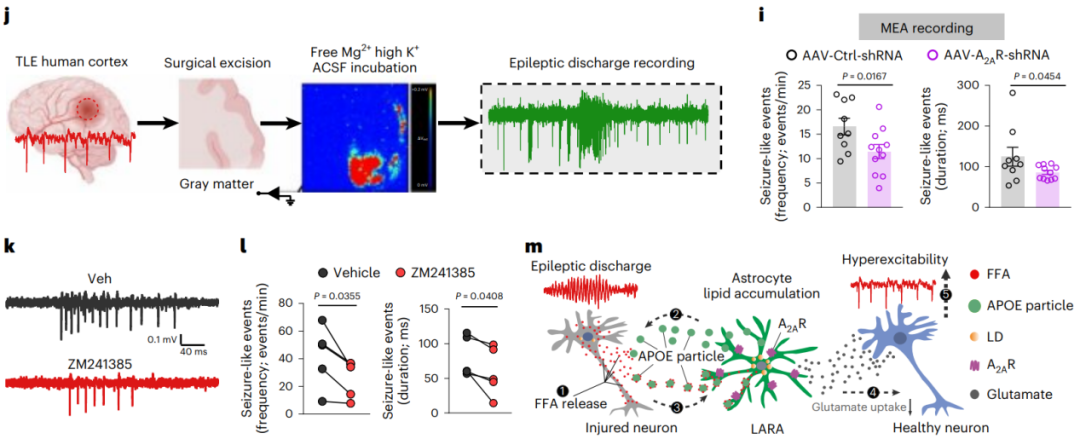
图7.脂质积累反应性星形胶质细胞通过A2AR促进癫痫小鼠的癫痫活动
本研究发现,在颞叶癫痫(TLE)患者和癫痫小鼠模型中,星形胶质细胞过度的脂质积聚会导致脂质积聚反应性星形胶质细胞(LARA)的形成,LARA会促进神经元过度活跃并加速癫痫病的发展进程。同时揭示了LARA的形成主要依赖于APOE的高表达,敲除APOE基因能够有效抑制癫痫小鼠LARA的形成和癫痫发作活性。
本研究首次发现了一种全新的星形胶质细胞--LARA,并深入揭示了LARA促进癫痫疾病发展进程的分子机制,丰富了人们对于星形胶质细胞病理功能的理解,为靶向星形胶质细胞治疗药物难治性癫痫奠定了理论基础。

