赋能下一代细胞疗法研发:in vivo CAR-T 技术与药康生物人源化小鼠模型的核心支撑
药康生物作为专注于动物模型研发与服务的领军企业,依托成熟的免疫系统人源化小鼠模型构建技术及标准化临床前药效评价体系,为in vivo CAR-T疗法的临床前研究提供了系统、可靠的技术支撑,助力科研人员高效推进相关领域的基础研究与转化应用。
一、in vivo CAR-T 技术:突破传统 CAR-T 的固有局限
(一)传统 Ex vivo CAR-T 的核心瓶颈
传统Ex vivo CAR-T疗法需经历 “患者外周血T细胞采集 — 体外基因改造 — 规模化扩增 — 回输患者” 的全流程。该模式不仅流程复杂、耗时较长,且治疗效果与安全性高度依赖患者自体 T 细胞的起始质量与数量,个体差异显著。此外,为保障回输CAR-T细胞的存活与增殖,患者需接受淋巴细胞清除性化疗(清淋预处理),这一过程易引发感染、骨髓抑制等并发症,进一步缩小了适用人群范围。
(二)in vivo CAR-T 的技术革新与优势
与传统技术相比,in vivo CAR-T具有三大核心优势:一是流程极大简化,单次注射即可启动治疗,大幅缩短疗程;二是降低个体依赖,无需依赖自体T细胞的体外扩增,拓宽了适用人群;三是安全性提升,规避了清淋预处理相关的感染风险。更重要的是,该技术为CAR-T疗法在实体瘤、自身免疫性疾病等传统难治领域的应用提供了新的技术路径。
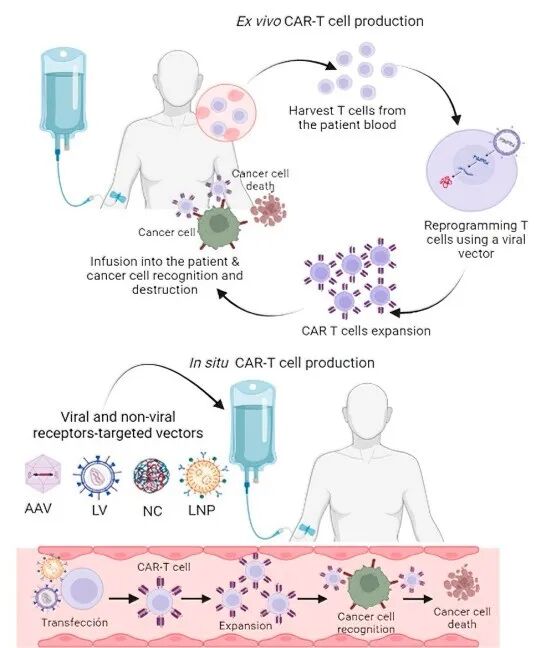
图1. 传统CAR-T(Ex vivo CAR-T)与in vivo CAR-T(In situ CAR-T)生产模式对比[1]
二、药康生物人源化小鼠模型:临床前研究的核心验证工具
临床前研究对in vivo CAR-T在复杂人体环境中行为的精准预测,是其成功转化的关键前提。药康生物构建的两类核心人源化小鼠模型,通过严格的实验验证,为该疗法的药效评价、基因编辑效率检测及动力学分析提供了可靠载体。
(一)huPBMC-NCG-MHC-dKO 小鼠模型:体内编辑有效性验证
实验设计遵循标准化流程:向NCG-MHC-dKO小鼠尾静脉接种Nalm6-Luc肿瘤细胞,腹腔注射2×10⁷ PBMC完成免疫系统重建后,给予抗CD19-CAR慢病毒载体;通过活体成像技术动态监测肿瘤负荷,借助流式细胞术检测人T细胞表面CAR表达情况。
实验结果显示,in vivo CAR-T治疗组对Nalm6-Luc肿瘤的生长呈现显著抑制作用,小鼠生存期较对照组明显延长;而对照组未表现出抑瘤效果,进一步验证了药物的有效性。同时,流式细胞术检测证实,治疗组人T细胞成功表达CAR,表明体内基因编辑过程高效且稳定。
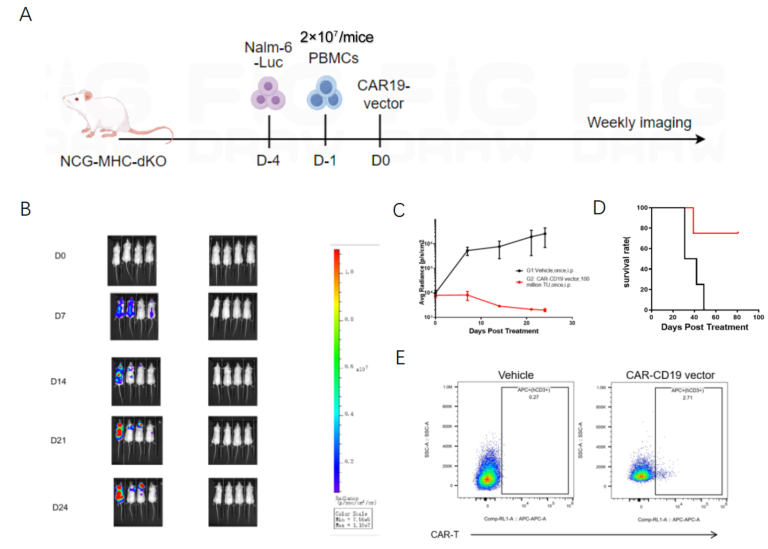
图2. in vivo CAR-T在huPBMC-NCG-MHC-dKO小鼠中的药效评价(合作验证数据)
(二)huHSC-NCG 小鼠模型:靶向功能与动力学评价
huHSC-NCG小鼠模型通过移植人CD34⁺造血干细胞(HSC),可实现人体免疫系统的长期、稳定重建,适用于in vivo CAR-T药物的靶向清除功能及体内动力学行为评价。
以治疗B细胞恶性肿瘤的临床候选药物UB-VV100(编码 CD19-CAR)为评价对象,实验中向huHSC-NCG小鼠腹腔注射不同剂量的UB-VV100载体后,流式细胞术检测发现:外周血中B细胞呈现剂量依赖性清除,且 CAR-T细胞比例随载体剂量升高而显著增加。该结果表明,该模型可精准评估in vivo CAR-T药物的靶向性与剂量效应关系。此外,该模型可与细胞系来源异种移植(CDX)、患者来源异种移植(PDX)模型结合,拓展至非B细胞靶点的药效评价,满足多方向科研需求。
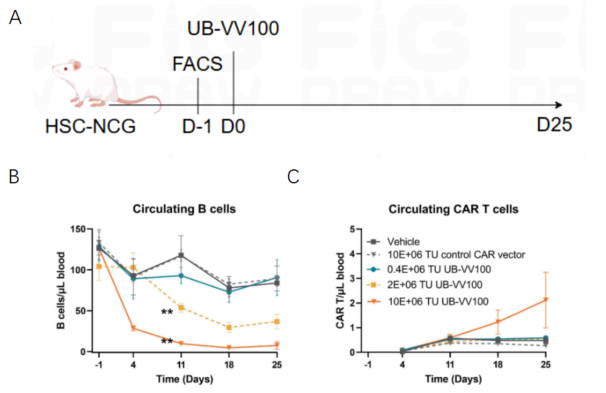
图3. in vivo CAR-T在huHSC-NCG小鼠中的药效评价[2]
三、药康生物平台优势:为科研提供全流程支撑
药康生物依托多年技术积累,构建了适配in vivo CAR-T临床前研究的完善服务体系,从模型供应到数据产出提供全流程支持,助力科研人员提升研究效率、保障数据可靠性。
(一)稳定的模型构建与供应能力
药康生物具备成熟的huHSC-NCG模型构建技术,可实现模型的定期标准化构建与高质量稳定供应,避免因模型制备周期过长影响实验进度,保障药效学与安全性评价的及时开展。
(二)标准化的 PBMC 重建体系
拥有丰富的PBMC供体资源库,结合标准化的免疫系统重建流程,可快速匹配不同研究需求的最优评价模型,有效降低个体差异对实验数据的影响,确保研究结果的可靠性与重复性。
(三)专业的技术服务经验
组建资深体内试验专家团队,累计完成300+ IND项目服务,具备深厚的CAR-T临床前研究经验。可提供 “模型定制 — 实验设计 — 样本检测 — 数据解析” 的一站式服务,为科研人员解决实验过程中的技术难题,加速研究成果向临床转化。
四、技术进展与科研价值展望
目前,in vivo CAR-T技术已成为下一代免疫治疗的核心发展方向,国内外多家生物技术企业纷纷布局相关研发,部分项目已进入临床研究阶段。然而,其临床转化仍面临人体免疫微环境模拟、基因编辑效率调控、长期安全性评估等关键问题,亟需可靠的临床前研究体系提供支撑。
药康生物构建的免疫系统人源化小鼠模型,能够精准模拟人体免疫环境,不仅可系统评估in vivo CAR-T的抑瘤疗效、靶向清除能力,还能验证体内基因编辑效率、CAR表达持续性及治疗安全性,为科研人员提供接近临床实际的研究载体。对于高校生物背景的科研学生而言,该模型可有效解决传统小鼠模型临床相关性不足、数据重复性差等痛点,助力其优化实验设计、提升研究数据质量,加速在血液瘤、实体瘤及自身免疫性疾病等领域的研究进展。
结语
in vivo CAR-T技术正推动细胞治疗从 “复杂定制化工程” 向 “便捷通用型药品” 跨越,而临床前研究的可靠性直接决定其转化效率。药康生物以高质量的人源化小鼠模型为核心,搭配专业的技术服务体系,为高校科研学生提供了稳定、高效的研究工具与全流程支持。未来,药康生物将持续深耕动物模型技术创新,不断完善临床前评价体系,助力更多科研人员突破技术瓶颈,加速下一代CAR-T疗法的研发与转化,为肿瘤免疫治疗领域的发展注入持续动力。
参考文献
[1] Int J Mol Sci. 2023 Oct 28;24(21):15688.
[2] J Immunother Cancer. 2023 Mar;11(3):e006292.

