高尿酸血症小鼠模型的构建|Uox-KO基因改造模型概述
现有的高尿酸血症(hyperuricemia,HUA)模型理论和技术趋于成熟,已在啮齿类,灵长类,禽类,鸟类和鱼类等机体上成功构建HUA模型,并根据HUA病理机制不同构建出不同类型的HUA模型,但存在模型不稳定、死亡率高、并发症严重、个体差异大等缺点,因此,建立稳定且能够反映临床病理特征的HUA动物模型具有重要意义。
高尿酸血症小鼠模型造模方法:
根据HUA的形成机制,制备HUA动物模型主要有两类:药物诱导模型和基因敲除模型。
一、药物诱导高尿酸血症小鼠模型
药物诱导模型是根据尿酸的代谢途径使用药物,通过增加尿酸来源或减少尿酸排泄来实现,又分为三类:增加尿酸的摄入、抑制尿酸的排泄、抑制尿酸酶活性。
1、增加尿酸的摄入
尿酸前体物质或者富含嘌呤食物可以促进尿酸的产生,常用的药物或食物主要有黄嘌呤、次黄嘌呤、酵母及沙丁鱼等。在短时间内给予大量的外源性尿酸,也可引起血尿酸明显升高,尿酸的进一步积累可能导致痛风,并存在引发心血管疾病、肾脏疾病和代谢综合征等的风险。
2、抑制尿酸的排泄
高体内的尿酸主要从肾脏清除,抑制肾脏排泄尿酸,可使血尿酸浓度增高,形成高尿酸血症。通过给予烟酸、乙胺丁醇等抑制肾脏的排泄功能,增加尿酸在体内的蓄积,从而增加体内血尿酸水平。
3、抑制尿酸酶活性
尿酸酶可催化体内尿酸氧化成尿囊素或其他物质,因此可以通过抑制或者消除尿酸酶的活性建立高尿酸血症模型。氧嗪酸及氧嗪酸盐可抑制尿酸分解成尿囊素,从而使尿酸水平升高,目前应用较为广泛,多采用饲喂法、灌胃法以及腹腔注射法进行造模。
二、基因敲除高尿酸血症小鼠模型
利用基因工程技术使动物产生尿酸酶的基因缺失,获得尿酸酶缺乏的小鼠,造成高尿酸血症模型。Uox是尿酸氧化酶基因,该基因确实导致尿酸分解严重受阻,造成严重的高尿酸血症;ABCG2是一种跨膜转运蛋白/高容量尿酸分泌蛋白,主要影响尿酸排泄,该基因敲除会导致尿酸水平升高,但升高水平有限。
基于药物诱导的高尿酸血症模型个体差异大,且血尿酸水平不稳定,而ABCG2 敲除模型仍保留了尿酸酶基因,与临床差异较大,不合适用来评价降尿酸药物,相比之下,Uox-KO模型是疾病研究和药物临床前评价的一个更合适的选择。
集萃药康相关Uox-KO模型概述:
集萃药康通过基因敲除技术构建Uox-KO小鼠模型,纯合小鼠表现出严重的高尿酸血症和尿酸肾病,纯合小鼠在出生几周后会陆续出现死亡(文献报导~65%的纯合小鼠在4周龄时死亡)。因此,Uox-KO小鼠出生后需别嘌呤醇等药物维持生存。
UOX小鼠表型及药效验证
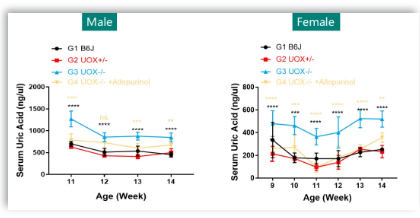
1. 雄鼠和雌鼠都自发出现高尿酸血症,雌鼠的平均尿酸水平较雄鼠低,但个体均一性较雄鼠好,别嘌呤醇可以显著改善因Uox敲除引起的小鼠高尿酸血症。
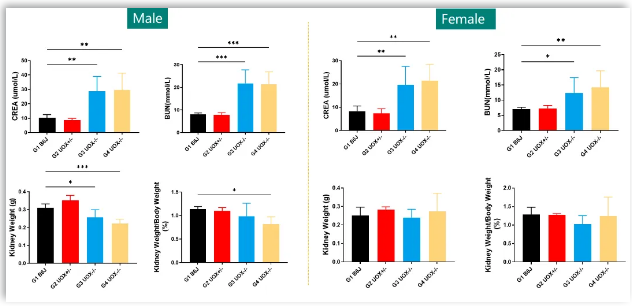
2. Uox-KO雄鼠和雌鼠肌酐、尿素氮水平升高,提示出现肾损伤,且雄鼠肾脏损伤较雌鼠更加显著,别嘌呤醇(G4组)无法改善Uox-KO引起小鼠的肾功能损伤。
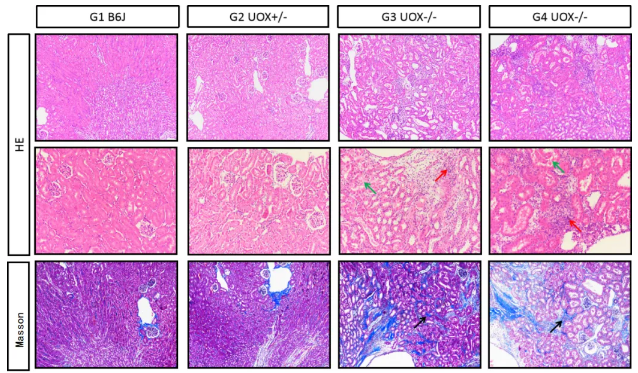
3. Uox-KO小鼠肾脏组织病理染色观察(HE & Masson),出现间质纤维组织增生,炎细胞浸润;肾小球萎缩,系膜组织增生;血管壁增厚;肾小管扩张形成囊肿;肾小管管腔内可见均质红染物质渗出。别嘌呤醇(G4组)无法改善Uox-KO引起小鼠的肾脏病变。
通过上述试验结果,我们确认Uox-KO小鼠具有和临床类似的尿酸水平升高和肾脏损伤现象,且高尿酸治疗药物在该小鼠上能表现出降血尿酸的药效,因此,该小鼠可作为高尿酸血症研究以及相关药物评价的合适模型。
参考文献:
1. 何宏明等,不同方法建立高尿酸血症动物模型研究进展[J]. 江西中医药,2015.
2. 张楠等,高尿酸血症动物模型的研究进展[J]. 昆明医科大学学报,2019.
3. Wu t al. Hyperuricemia and urate nephropathy in urate oxidase-deficient mice[J]. Proc Natl Acad Sci USA. 1994.

