基因鉴定
-
-
-
核酸提取与质量控制
-

-
-
-
PCR体系构建
-

-
-
-
PCR程序说明
-

-
-
-
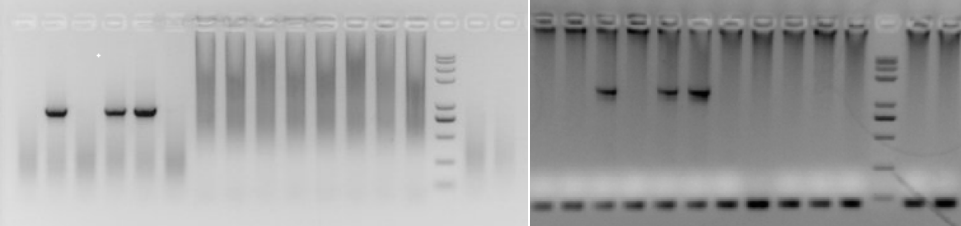
凝胶电泳
-

-
-
-
鉴定服务与寄送标准
-

-
-
-
常见问题及解决方案
-
1、PCR假阴性(扩增条带弱或无条带)

A 特征
● 样品目的条带无法扩增或条带弱;
● 阳性对照同样没有条带或条带极弱;
B 原因
● 目的片段条带过大导致扩增效率低;
● DNA模板质量较差或扩增体系不合适(扩增酶扩增效率不高或PCR程序不合适等);
● PCR仪温控模块差异;
C 解决方式
● 设计备用引物,尽量缩短PCR产物大小;
● 使用试剂盒提取纯化DNA模板或优化鉴定体系(建议参照集萃药康推荐的程序进行鉴定);
● 可尝试使用三步法PCR程序进行扩增,同时由于仪器、操作等环节依然存在变量,若上述处理无法改善,建议梯度测试最优退火温度。
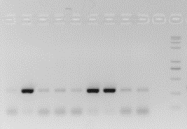
2、PCR假阴性(泳道弥散状、伴随核酸挂孔或较严重的引物二聚体现象)
A 特征
● 胶孔大量发光,DNA无法脱离胶孔;
● 泳道出现弥散状抹带,通常伴随挂孔现象;
● 在胶图的最下方,常有比较明显的非目的条带;
B 原因
● DNA通过碱裂解、一步法试剂盒提取,未经纯化使用,蛋白裹在核酸上,导致核酸无法跑出胶孔;
● DNA模板附着较多杂质,影响引物的退火结合;
● 弥散的泳道通常为一些降解的核酸片段;
C 解决方式
● 重新纯化提取DNA或稀释DNA模板(降低杂质比例);
● 更换备用引物或者使用高效率的扩增酶;
● 及时电泳,避免扩增产物长时间存放室温或4℃冰箱。
3、PCR假阳性(出现扩增污染)
A 特征
● 阴性对照、空白对照出现不符合预期的条带,通常会稍弱于阳性样品的主带,偶有与主带完全相同的亮度;
● 常发生于PCR产物小于500bp的反应中,产物越小,污染可能性越高;
B 原因
● 样品交叉污染,包括DNA模板、扩增体系配置或者电泳时污染;
● 气溶胶污染,少量样品鉴定时偶发,大批量样品鉴定、或者长时间使用同一对引物鉴定时发生频率明显增高;
C 解决方式
● 轻微污染时,提高退火温度、减少3-5循环、稀释DNA模板同时进行;
● 污染严重时,重新设计备用引物检测,条带不小于500bp,同时使用上述调整体系。
4、PCR特异性差(存在非特异性条带)
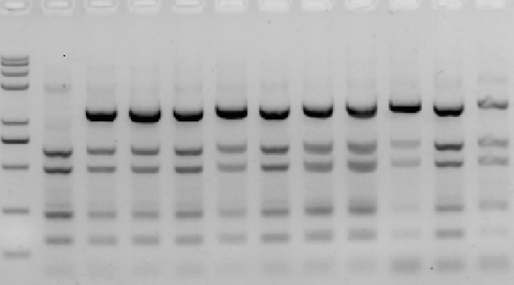
A 特征
除目的条带外,存在其他特异性扩增的产物,有时非特异性产物与目的带接近,影响结果判定;
B 原因
● 引物不特异;
● 酶的效率太强、退火温度偏低、退火延伸时间过长;
C 解决方式
● 非特异性扩增条带较弱时,提高退火温度、减少3-5循环、稀释DNA模板同时进行,可有效抑制非特异性扩增;
● 非特异性扩增条带较强时(杂带亮度与目的带几乎一样或者更亮),重新设计PCR引物。
5、PCR优势扩增
 A 特征
A 特征被检个体处于杂合状态时,有时会出现较短片段等位基因扩增产物高于或低于较长片段扩增产物,甚至可能有一条带完全无法扩增;
B 原因
● 当一个PCR反应中存在超过一种产物时,不同的产物会存在竞争性扩增,导致其中一种产物的产量远大于其他产物;
● 通常小条带比大条带更容易扩增,且两条带差距越大,优势扩增现象越明显;
● 个别情况下,比如产物序列存在特殊结构,也会出现大条带优势扩增现象;
C 解决方式
集萃药康鉴定方案为避免优势扩增干扰,通常两条带差距超过300bp,会分别设计引物用于验证,避免优势扩增出现。
6、电泳条带弯曲
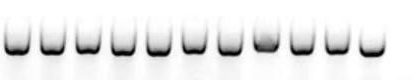
A 特征
电泳结果出现“笑脸状条带”;
B 原因
制备琼脂糖凝胶时,煮沸后部分水分蒸发,导致琼脂糖凝胶中的电泳液浓度,高于电泳槽中的电泳液浓度。此时胶孔中的PCR产物,中心区域迁移速率快,周围靠近电泳液的产物迁移速率慢,展现出严重的弯曲;
C 解决方式
煮沸凝胶后,需要添加蒸馏水,补足蒸发的体积,需要注意缓慢添加,并同时均匀晃动,避免局部降温过快,导致凝胶冷却不均匀产生结块。
7、实际电泳条带与目的带大小不符
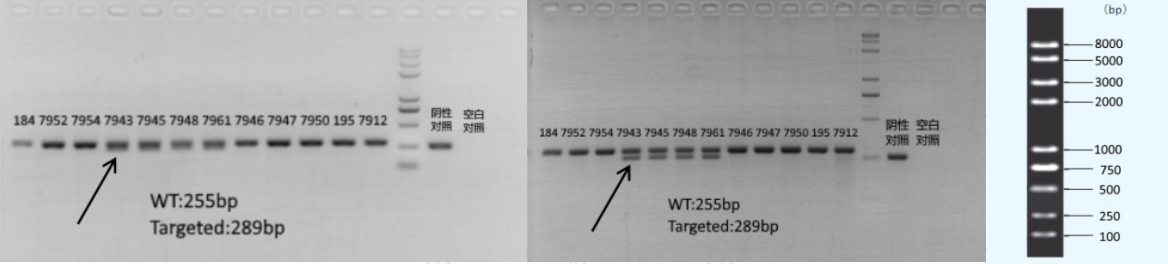
A 特征
经过与Marker或其他对照比较,实际胶图上的目的带与鉴定方案中标记的产物大小不符;
B 原因
● 凝胶问题(质量较差、浓度较低)或者电泳时间不合适;
● Marker质量问题;
● 序列更新或标记的产物大小有偏差;
C 解决方式
● 调整凝胶浓度、电泳条件等条件(建议参照集萃药康推荐的电泳体系);
● 更换合适品牌的Marker;
● 尝试使用备用引物。
-
-
-
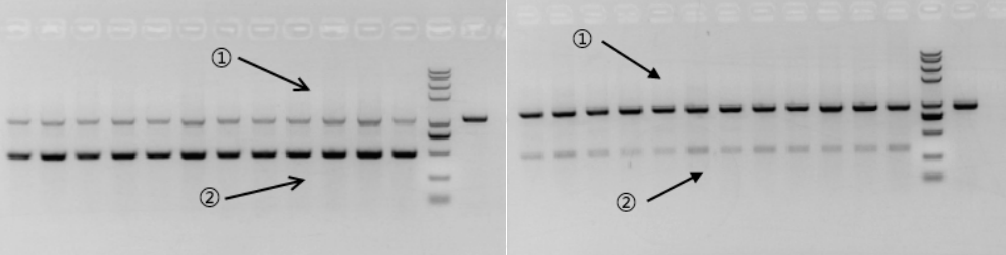
PCR的优势扩增
-
在同一个PCR反应体系中,存在2种或两种以上的PCR产物时,不同的产物扩增效率存在差异,即为PCR的优势扩增现象(如图示1,产物②的扩增效率明显高于产物①)。
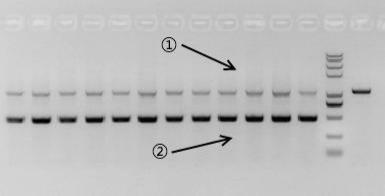
图示 1
表现形式:
当两种产物的GC含量接近、产物中都不存在特殊结构且延伸时间足够时,小条带的扩增效率高于大条带的扩增效率。
产生原因:
①由于Taq酶在反复的变性-退火-延伸过程中,酶的活性在持续降低(通常35-40循环后酶完全失活),而20-40循环中随着酶活的降低,大片段产物的延伸富集效率也大大降低,而小片段的延伸效率受影响较小,故PCR循环中,小片段产物的扩增含量将远大于大片段的产物;
②部分反应体系中,引物对于模板的敏感性较低,若在PCR循环的初始阶段(前5-10循环),已经产生了大量的小片段产物富集,那么后续的循环中,大多数反应会以小片段的产物作为模板进行扩增;
以上两个因素叠加,导致小片段产物的含量远大于大片段产物的含量(可达指数级的差异),
故电泳时,小条带亮度将远大于大条带的亮度,甚至完全无法检测到大条带的存在。
优化方案:
将鉴定不同基因型的反应,分别进行PCR扩增,即在设计PCR方案时,优选每种产物的特异性验证方案(通常判断最小条带为有效扩增条带,大条带无论是否扩增成功,由于存在风险较大,不作判断使用)。
其他调整方案:①更换品牌更佳的taq酶,让高循环数时的酶活尽量保持最 佳状态;②更换扩增引物,尽量避免低循环的产物富集。
特殊情况:
在两种产物的片段存在结构上的差异、或存在明显的GC含量区别时,优势扩增的产物将变为GC均匀、且不含高级结构的那份产物,此效率甚至可以覆盖上述条带所产生的扩增效率差异。如图示2所示,产物①的GC含量均匀,但产物②的GC含量极高,所以即使产物②条带远小于产物①,但扩增效率仍然是产物①更高。
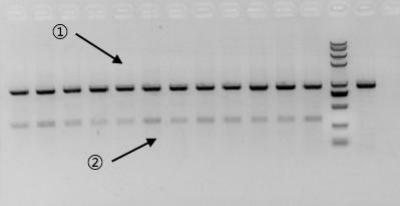
图示 2
-
-
-
气溶胶污染
-
什么是核酸气溶胶污染?
核酸气溶胶污染, 即 DNA/RNA 气溶胶污染,是实验室中极易出现的一种空气污染。空气与液体的液面摩擦, 离心机离心,剧烈摇动反应管, PCR 开盖,移液器反复吸样, 污染物外泄等情况均会产生核酸气溶胶 。这类污染的危害对于 PCR 实验结果尤其显著 :极微量的核酸气溶胶污染, 即可形成 PCR 扩增假阳性。
气溶胶污染的表现形式:
● PCR 实验中, 以去离子水为模板的 PCR 产物, 也可以扩增出目的条带, 在排除体系污染 、样品间交叉污染的情况下, 即可认为存在气溶胶污染;
● 由于此类污染的 PCR 扩增模板实际为游离的气溶胶核酸片段, 通常情况下为核酸碎 片 , 且含量极低, 对于大片段的 PCR 扩增影响较小, 故通常出现在 PCR 产物大小在80-500bp 的 PCR 反应中。
气溶胶污染的预防及清理措施:
● 良好的实验习惯: PCR 实验前, 使用 75%乙醇, 进行桌面 、移液器的擦拭; 实验过程 中 , DNA 提取 、 引物溶解 、 PCR 体系配置时,尽量避免剧烈震荡, EP 管的开关尽量轻柔,如发生样品飞溅时,及时使用 75%乙醇擦拭 2 次。
● 实验室环境控制 :保持每天至少 4 个小时的通风, 尤其是冬夏开空调时期, 气溶胶污染高发。
● 当已经发现气溶胶污染时, 除了上述操作外, 我们会每天增加 8 小时的紫外照射, 并 开启实验室的负压通风装置, 由于气溶胶污染的顽固性, 通常 3 -4 周, 才可以完全清 除 。 而对于进行中的 PCR 实验, 我们建议在超净台/通风橱进行 PCR 实验, 开封新的试剂 、耗材(EP 管 、 引物 、酶 、 去离子水等) , 由于气溶胶核酸片段不完整 、含量较 低, 所以提高 PCR 程序中的退火温度, 同时降低 3 -5 个循环, 效果也比较明显; 条件 允许时, 可以尝试更换 PCR 扩增区域, 将扩增片段控制在 800bp 左右, 也可以有效避免此类问题。
-



