
代谢及心血管疾病模型
机体代谢紊乱会引起代谢物质在体内不正常的堆积或缺乏,从而导致一系列与代谢相关疾病的发生,严重威胁人类健康。药康生物自主研发一系列代谢疾病模型,如肥胖、糖尿病、高脂血症、代谢功能障碍相关脂肪性肝病、痛风/高尿酸血症、骨质疏松症等,用于致病机制研究及相关治疗药物开发。
动脉粥样硬化(atherosclerosis,AS)是一种慢性进行性血管疾病,以动脉管壁增厚变硬、失去弹性和管腔缩小为特征,是导致心脑血管疾病的主要病理基础。目前载脂蛋白 E 基因敲除(ApoE -/-)小鼠和低密度脂蛋白受体基因敲除(LDLR -/-)小鼠是最常用的动脉粥样硬化动物模型,集萃药康能够提供这2种经典动脉粥样硬化模型小鼠及经验丰富的药效服务。此外,集萃药康也实现了通过AAV注射PCSK9结合西方饮食喂养的方式在不同基因型小鼠(免疫靶点人源化小鼠)上迅速构建动脉粥样硬化模型。
相关小鼠模型
AAV-hPCSK9 + 西方饮食诱导的动脉粥样硬化
模型介绍
动脉粥样硬化(AS)是一种慢性炎症性疾病,也是心血管疾病(如冠心病、中风等)的主要病理基础,严重威胁人类健康。前蛋白转化酶枯草溶菌素 9 型(PCSK9)是一种与脂质代谢密切相关的蛋白质。PCSK9 通过与低密度脂蛋白受体(LDLR)结合,促进 LDLR 的内吞和降解,从而减少细胞表面 LDLR 的数量,升高血液中低密度脂蛋白胆固醇(LDL-C)水平。研究表明,PCSK9 基因的异常表达与高胆固醇血症和动脉粥样硬化的发生发展密切相关。通过构建携带人 PCSK9 基因(hPCSK9)的腺相关病毒载体(AAV-hPCSK9),可在小鼠体内实现 PCSK9 的高效表达,进而升高小鼠血液中的 LDL-C 水平,加速动脉粥样硬化进程。将 AAV-hPCSK9 介导的 PCSK9 过表达与西方饮食相结合,能够快速有效地诱导小鼠动脉粥样硬化模型的形成。该模型重现了人类动脉粥样硬化的病理特征,如脂质沉积、炎症细胞浸润和血管内膜增厚。
验证数据
① AAV注射后hPCSK9蛋白表达
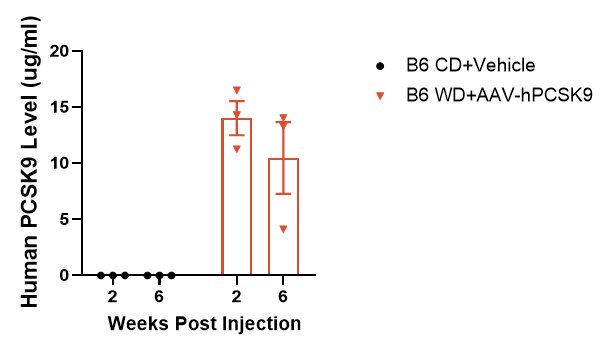
图1. AAV注射后2周和6周血浆中hPCSK9蛋白表达。数据以Mean±SEM表示,n=3。
② AAV-hPCSK9联合西方饮食诱导B6小鼠高胆固醇血症
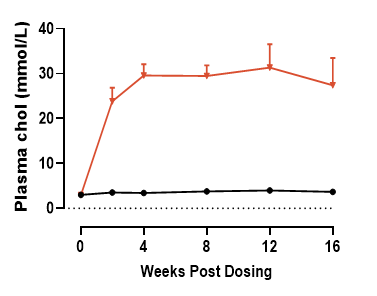
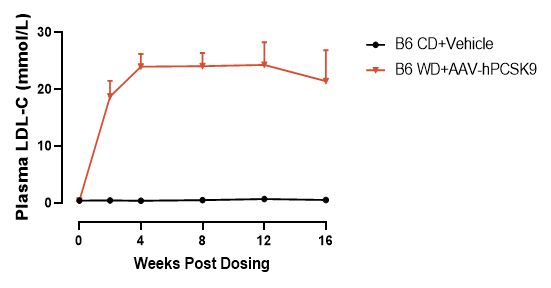
图2. AAV 注射后血浆胆固醇和低密度脂蛋白水平检测结果。数据以Mean±SEM表示,n = 3。
③ AAV-hPCSK9 联合西方饮食诱导 B6 小鼠发生动脉粥样硬化
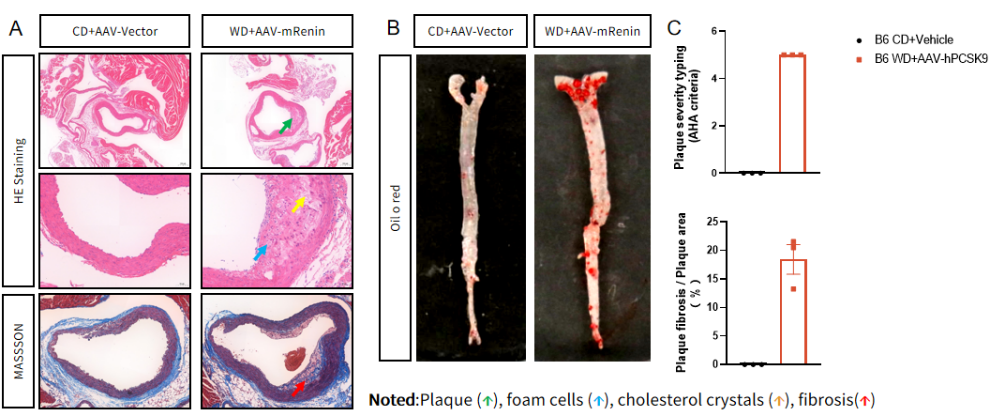
图 3. (A)主动脉根部 H&E 染色和 Masson 染色评估动脉粥样硬化;(B)整根主动脉油红 O 染色评估动脉粥样硬化;(C)斑块评分和斑块纤维化统计分析。
2. Apoe-KO
模型介绍
APOE 主要负责脂蛋白、脂溶性维生素和胆固醇的转运。在外周组织中,APOE 主要由肝脏和巨噬细胞产生,介导胆固醇代谢。在中枢神经系统中,APOE 主要由星形胶质细胞产生,通过 APOE 受体将胆固醇转运至神经元。此外,APOE 是大脑中胆固醇的主要载体。研究表明,APOE 缺陷小鼠在清除血浆中的乳糜微粒、极低密度脂蛋白(VLDL)和低密度脂蛋白(LDL)方面存在障碍,胆固醇含量显著升高。Apoe 小鼠对胆固醇极为敏感,当胆固醇进入血浆后会发生积聚。大约 3 个月时,主动脉附近出现脂肪条纹,形成动脉粥样硬化前期病变,并随着年龄增长而发展。老年 Apoe 缺陷小鼠(超过 17 个月)会出现由胆固醇结晶凝块、脂滴和泡沫细胞组成的黄瘤病变,在脉络丛和腹侧肌腱中可见较小的黄瘤。研究还发现,Apoe 基因敲除小鼠存在学习和记忆障碍。
验证数据
① APOE 蛋白表达的测定
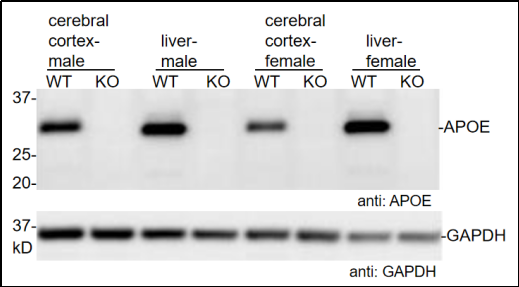
图 1. 大脑和肝脏组织中 APOE 的蛋白表达
使用特异性抗体(Abcam,ab183596)通过蛋白质免疫印迹法(Western Blot)测定大脑和肝脏组织中 APOE 的蛋白表达。WT:C57BL/6JGpt 野生型小鼠;KO:Apoe-KO 纯合子小鼠。(数据来源:Abcam 合作验证)
② 血脂检测
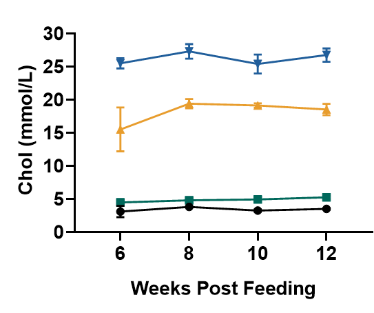
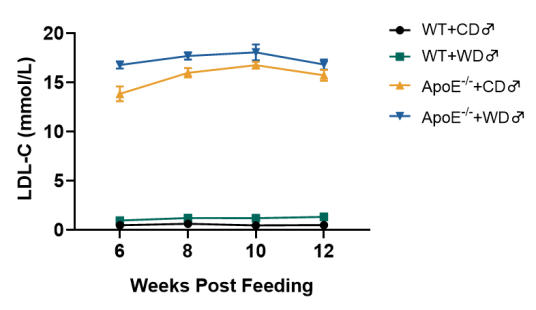
图 2. ApoE-/-小鼠血脂检测
与野生型小鼠相比,喂食西方饮食(WD)(D12079B)的ApoE-/-小鼠的胆固醇和低密度脂蛋白胆固醇(LDL-C)水平显著升高。
③ 病理分析
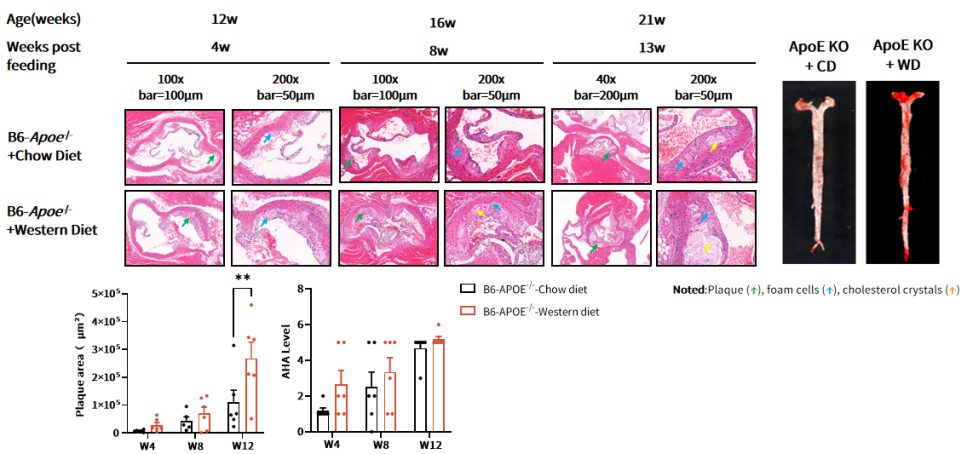
图 3. ApoE-/-小鼠主动脉的H&E染色和油红 O 染色
从 8 周龄开始,给 ApoE-/- 小鼠喂食普通饲料(CD)和西方饮食(WD)(D12079B)。饲喂西方饮食 12 周后,通过 H&E 染色可在主动脉根部观察到面积较大的动脉粥样硬化斑块。通过对整根主动脉进行油红 O 染色,也可检测到富含脂质的斑块(红色)。配对 t 检验,**,p<0.01。
④ 药效数据
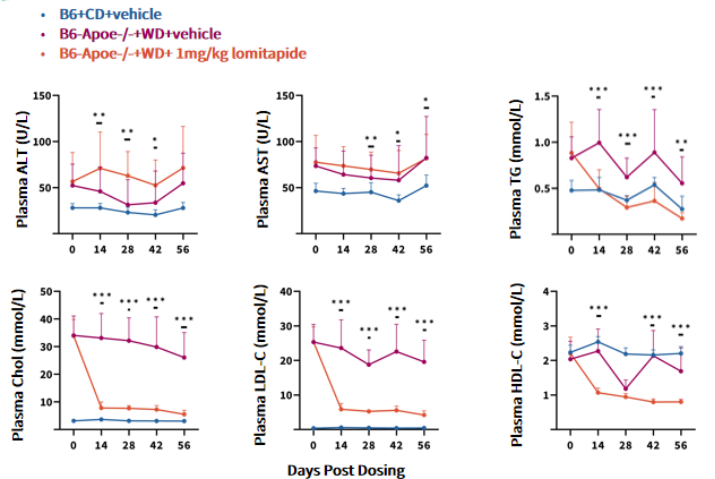
图 6. 洛美他派(Lomitapide)对ApoE-/-小鼠的降脂作用
数据以Mean±SD表示,采用双因素方差分析(Two-Way ANOVA)。* ,** ,**分别表示 p<0.05,p<0.01,p<0.001。
3. Ldlr-KO
模型简介
低密度脂蛋白受体(LDLR,Low-Density Lipoprotein Receptor),即 LDL 受体,是低密度脂蛋白受体家族的成员。LDL 受体可清除低密度脂蛋白(LDL)和中密度脂蛋白(IDL),从而调节血浆胆固醇水平。研究表明,Ldlr 基因缺陷小鼠的血浆总胆固醇水平是野生型小鼠的两倍,且低密度脂蛋白受体对高胆固醇血症敏感。此外,小鼠中 Ldlr 基因的过表达可抑制高胆固醇饮食引起的血浆高胆固醇血症。Ldlr 基因缺陷小鼠模型对糖尿病肾病、动脉粥样硬化、高脂血症和高血糖的临床研究具有重要意义。
验证数据
① 正常饮食和高脂饮食下对照和Ldlr敲除小鼠的血脂水平
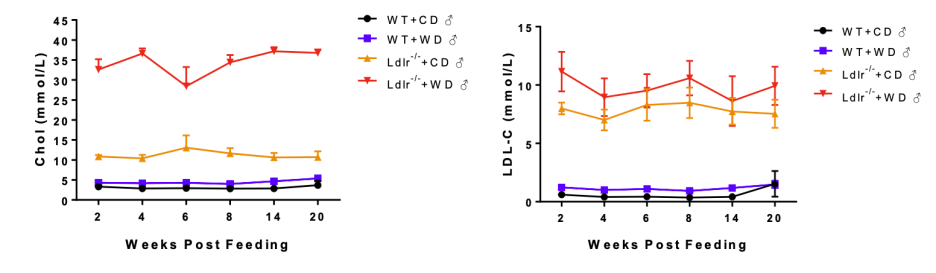
图1. 在正常或西方饮食条件下的Ldlr-/-小鼠中,均观察到血浆胆固醇和低密度脂蛋白胆固醇水平的升高。数据以Mean±SEM呈现。
② 主动脉油红O染色
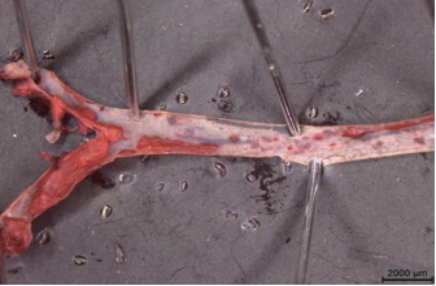
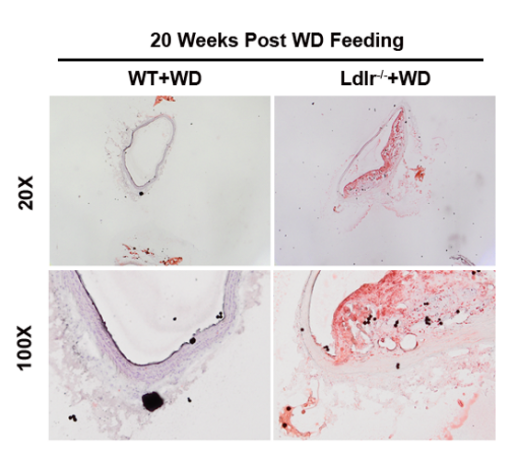
图2. 油红O染色显示西方饮食诱导20周后的Ldlr-/-小鼠主动脉周围出现大量脂质沉积
③ 药效数据
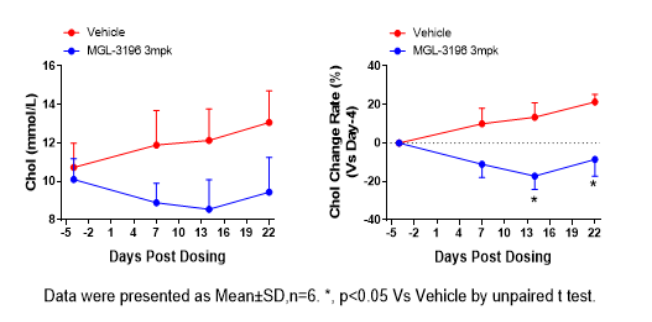
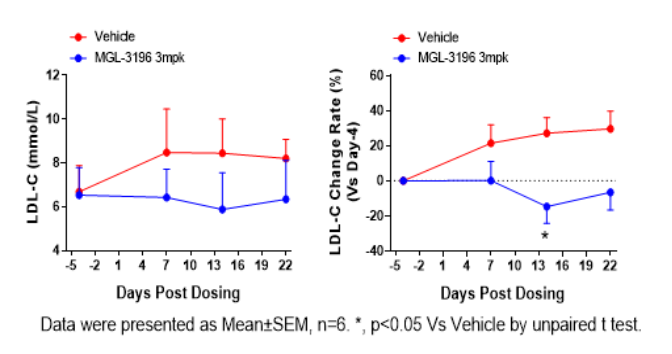
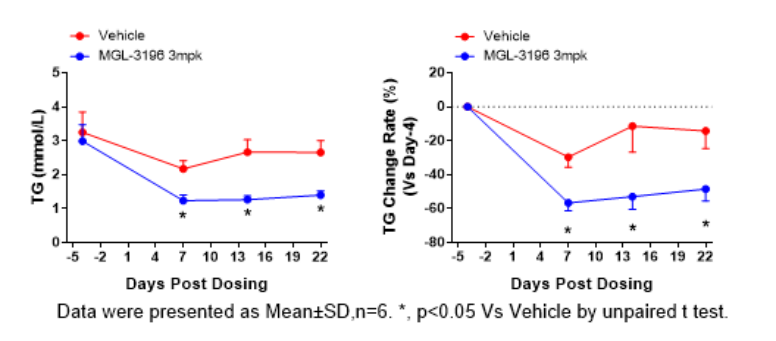
图3. MGL-3196干预后总胆固醇、低密度脂蛋白胆固醇及甘油三脂水平下降。数据以Mean±SD展示,n=6。使用 t-test方法进行统计学分析。*,P<0.05。

