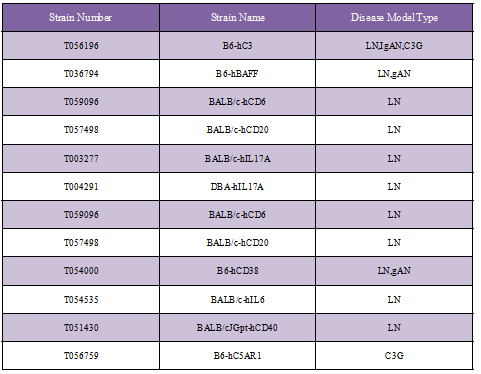
多种肾病小鼠模型选择:集萃药康基于药物MOA的肾病小鼠模型品系
自身免疫性肾病(Autoimmune Nephropathy)是由各种疾病引起的原发于肾脏的慢性肾小球疾病,以肾活检免疫病理检查在肾小球有免疫复合物沉积为特征,临床表现有血尿、蛋白尿、水肿、高血压等,主要疾病类型有狼疮肾炎、IgA肾病、C3肾小球病等。
一、狼疮性肾炎
狼疮性肾炎(Lupus Nephritis,LN)是系性红斑狼疮(SLE)引起的肾脏不同病理类型的免疫性损害,同时在临床表现上伴有明显肾脏受损的一种疾病,狼疮肾炎发生在约30%-50%的SLE患者中[1]。LN是肾病中严重影响患者生存率的主要原因之一,约5%-20%的LN患者10年内演变成终末肾脏病(ESRD),LN患者15年生存率约75%,严重影响患者生存质量。
目前LN的治疗是根据肾损害、肾外损害、狼疮活动性、肾病理类型选择治疗方案。现传统糖皮质激素联合环磷酰胺仍为当前治疗LN的一线方案,但长期使用激素及免疫抑制剂往往带来感染、骨髓抑制、继发肿瘤等毒副作用,给患者带来很大不便。因此,关于LN治疗,临床仍有大量未被满足需求。
BAFF是一种B细胞激活因子(B-cell-activating factor of the tumour-necrosis-factor family,BAFF),别名TNF superfamily member 13b(TNFSF13B)。BAFF通常在SLE患者体内过度表达,并与该疾病的发病机制密切相关。过量的BAFF表达可以促进自身反应性B细胞增殖,驱动自身免疫反应。
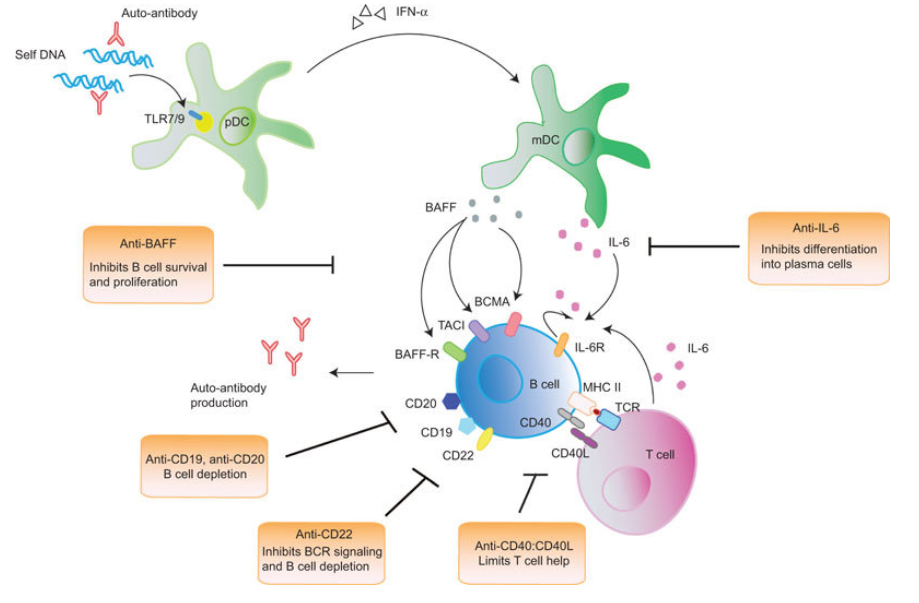
图1:B细胞在LN中的作用
狼疮性肾炎用模型选择:B6-hBAFF 自发狼疮肾炎模型
集萃药康为加速LN药物研发,利用基因编辑技术制作了过量表达人源BAFF的转基因小鼠,与野生型小鼠相比,B6-hBAFF小鼠肾脏出现肾小球肿大,新月体形成以及免疫复合物如C3的沉积,肾脏病理指数显著升高,适用于靶向B细胞及BTK通路的药物在SLE、LN疾病中的药效评价。
部分数据展示:
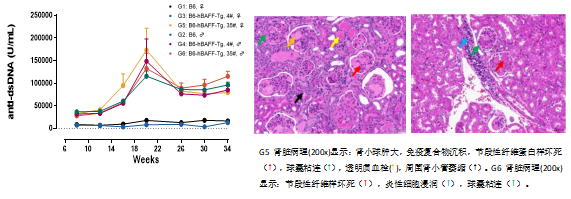
图2:左图为B6-hBAFF小鼠从8周龄开始血清Anti-dsDNA水平显著升高;右图为B6-hBAFF小鼠在25周龄时出现严重的肾脏组织病变。

图3:C3免疫荧光染色。B6-hBAFF小鼠(中&右)显示明显的肾小球C3沉积。
二、IgA肾病
免疫球蛋白A肾病(IgA Nephropathy,IgAN)是世界范围内最常见的原发性肾小球疾病,占原发性肾小球肾炎的30%-40%,大约20%-40%的IgA肾病患者会在诊断后10-20年进展至ESRD[3]。IgA肾病可表现为各种临床综合征,包括无症状性血尿或蛋白尿、慢性肾小球肾炎、急进性肾炎或肾病综合征。
IgA肾病的病理机制还未完全明确,但是,目前被广泛接受的理论认为,IgA肾病是多种机制共同导致的,而非单一机制,被称为“多重打击假说”。总的来说,此假说有4个环节:①异常糖基化IgA1,进而生成半乳糖缺陷的IgA1抗体(Gd-IgA1);②被循环系统中抗聚糖的自身抗体识别;③导致肾炎的免疫复合物沉积在系膜区;④激发炎症级联反应,导致IgA肾病[4]。
一直以来,IgA肾病缺乏特异性治疗,传统方案包括RAS抑制剂、激素、免疫抑制剂等均非对因治疗手段。今年4月,全球首 个对因治疗IgA肾病,延缓肾功能衰退的首创药物,靶向肠道黏膜免疫调节剂---Nefecon(耐赋康,布地 奈德迟释胶囊)获得了海南省药品监督管理局批准,耐赋康是口服靶向布地 奈德迟释胶囊,通过特殊的制作工艺,将布地 奈德靶向释放于回肠末端的黏膜B细胞(包括Peyer’s淋巴结),从而减少Gd-IgA1产生,进而干预发病机制上游阶段,达到治疗IgA肾病的作用。这为IgA肾病迈入精准医疗时代打下了坚实的基础。值此之际,集萃药康自主研发了IgA肾病小鼠模型助力新药开发。
IgA肾病用模型选择:BSA-CCl4-LPS诱导IgA肾炎模型
集萃药康采用BALB/cJGpt 6-7w雌鼠,使用牛血清白蛋白(BSA)、四氯化碳(CCL4)以及LPS联合诱导IgA肾炎模型。
部分数据展示:
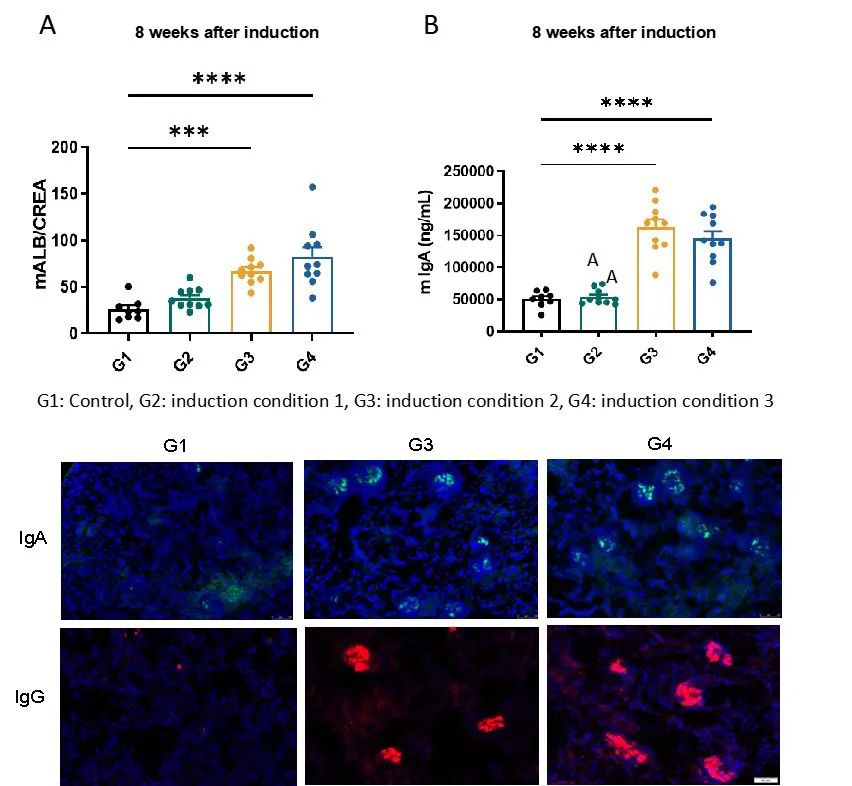
图4:与G1对照组相比,G3,G4造模组尿微量白蛋白/尿肌酐升高(A),血清IgA显著升高(B),肾脏出现IgA及IgG沉积(C),表明造模成功。
三、C3肾小球病
C3肾小球病(C3 Glomerulopathy,C3G)是一类由于先天性遗传变异及获得性自身抗体介导的补体旁路途径异常活化导致的罕见肾小球疾病。肾活检是诊断C3肾小球病的金标准。2013年C3肾小球病专家共识中指出:根据电镜下电子致密物沉积特点可将C3肾小球病分为致密物沉积病(dense deposit disease,DDD)和C3肾小球肾炎(C3 glomerulonephritis,C3GN)[5]。
C3G发病机制是补体旁路途径的异常激活引起C3沉积。补体旁路途径失调是C3G发病机制中的主要驱动因素,其病因包括获得性因素(自身抗体)和遗传因素(遗传变异)。(1)自身抗体:与C3G相关的主要自身抗体是C3肾炎因子和C5肾炎因子,可稳定C3和C5转化酶,延长它们的半衰期。此外,还包括抗H因子、抗B因子及抗C3b自身抗体。(2)遗传变异:补体基因的遗传异常可能驱动旁路途径的过度激活,包括C3、CFB、CFH、CFI、CFHR基因突变;CFH、C3、CFB和MCP基因的遗传多态性;CFH-CFHR基因座的基因组重排导致突变蛋白。此外,单克隆球蛋白可激活补体旁路途径,导致C3G[6]。
关于C3肾小球病的最佳治疗方案尚不明确,目前的治疗方案包括:免疫抑制剂疗法、生物制剂疗法、血浆疗法、补体靶向疗法以及肾移植等[6],近年来C3G已成为研究热点,但关于补体旁路激活途径、遗传基础、自身抗体形成在C3G发病过程中的确切作用仍不明确,因此需要投入更多研究来证实,并需要开发有效并针对性的治疗方法。
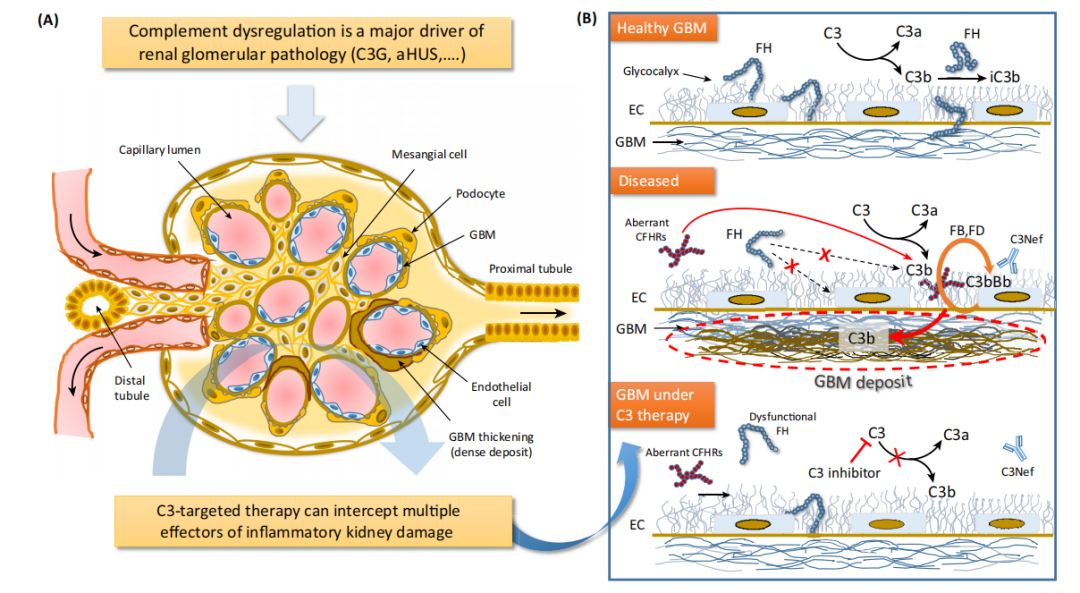
图5:C3靶向干预阻断肾脏病理的多种促炎效应物。
C3肾小球病选择:B6-hC3自发C3肾小球肾病模型
部分数据展示:

图6:C3人源化小鼠血清中可检测到人源化C3(A),且UACR(尿蛋白/尿肌酐)相较于野生型小鼠显著升高,说明肾脏功能受损。
集萃药康自主研发的C3人源化小鼠模型,可针对靶向C3的药物进行临床前药效评价。
基于药物MOA的肾炎小鼠模型选择

肾病相关靶点人源化小鼠
集萃药康自免平台可提供动物模型和技术服务,并可定制药物开发临床前一站式服务,主要聚焦系统性红斑狼疮、炎性肠病、多发性硬化症、银屑病、特应性皮炎、类风湿性关节炎、特发性肺纤维化等疾病领域。
自免临床前一站式服务
参考文献:
1. Carole Burger, Antoine Créon, Alexandre Karras,Time for new therapeutic options in lupus nephritis,Joint Bone Spine,Volume 89, Issue 6,2022
2. M.G. Tektonidou, A. Dasgupta, M.M. Ward.Risk of end-stage renal disease in patients with lupus nephritis, 1971–2015: a systematic review and Bayesian meta-analysis: ESRD RISK IN LUPUS NEPHRITIS ,Arthritis Rheumatol, 68 (2016), pp. 1432-1441
3. Pattrapornpisut P, Avila-Casado C, Reich HN. IgA Nephropathy: Core Curriculum 2021. Am J Kidney Dis. 2021 Jul 9:S0272-6386(21)00598-9.
4. 田秀娟,黄晨.IgA肾病免疫炎症发病机制研究进展[J].中华肾脏病杂志,2020,(4)(05):400-405.
5. PickeringMC,D'AgatiVD,NesterCM, et al.C3 glomerulopathy: consensus reportJl. Kidney lnt
2013,84(6):1079-1089.DOl: 10.1038/ki.2013.377
6. 朱慧兰,柴华旗蒋飞.C3肾小球病发病机制及治疗的研究进展[J]. 临床和实验医学杂志2019,18(07):782-785

